铝及化合物测试

2009届高三化学各地月考试题汇编:
铝及化合物(2)
1.(湖南长郡中学2009届高三第三次月考)把一块镁铝合金投入到1mol/L HCl 溶液里,待合
金完全溶解后,往溶液里加入1mol/L NaOH 溶液,生成沉淀的物质的量随加入NaOH
溶液体积变化的关系如下图A 所示。下列说法中不正确的是
图A 图B 图C
A .a 的取值范围为0≤a <50
B .()()
Al Mg n n 的最大值为2.5mol C .若将关系图改为B 图时,则a 的取值范围为80<a <90
D .若将关系图改为C 图时,则a 的取值范围为75<a <90
2.(江苏省启东中学2009届高三10月调研测试)(8分)盐R 的化学式为X m Y n Z p (X 、Y 、
Z 为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R 的水溶液进
行如下实验:
Ⅰ.取一份R 的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉
淀量先增加后减少,最终剩余沉淀甲4.66g ,且甲不溶于稀盐酸;
Ⅱ.取另一份R 的水溶液与过量的NaOH 溶液混合加热,生成具有刺激性气味的气
体乙0.224L (标准状况),乙能使湿润的红色石蕊试纸变蓝。据此回答:
(1)写出R 和甲的化学式:R
;甲 。
(2)另取500mL R 的水溶液,向其中逐
滴加入NaOH 溶液,所得沉淀与加入的NaOH
的物质的量关系如图所示。则:
①B 点处溶液中离子浓度从大到小的顺序是
。 ②R 溶液的物质的量浓度为 。
③BC 段表示的含义是 。
④CD 段表示的含义是 。
答案(1)NH 4Al(SO 4)2(1分);BaSO 4(1分)
(2)c (Na +)>c (SO 42—)>c (NH 4+)>c (H +)>c (OH —)(2分);2mol/L (2分)
NH 4+与OH —生成NH 3·H 2O (1分)
Al(OH)3与NaOH 反应,沉淀逐渐溶解(1分)
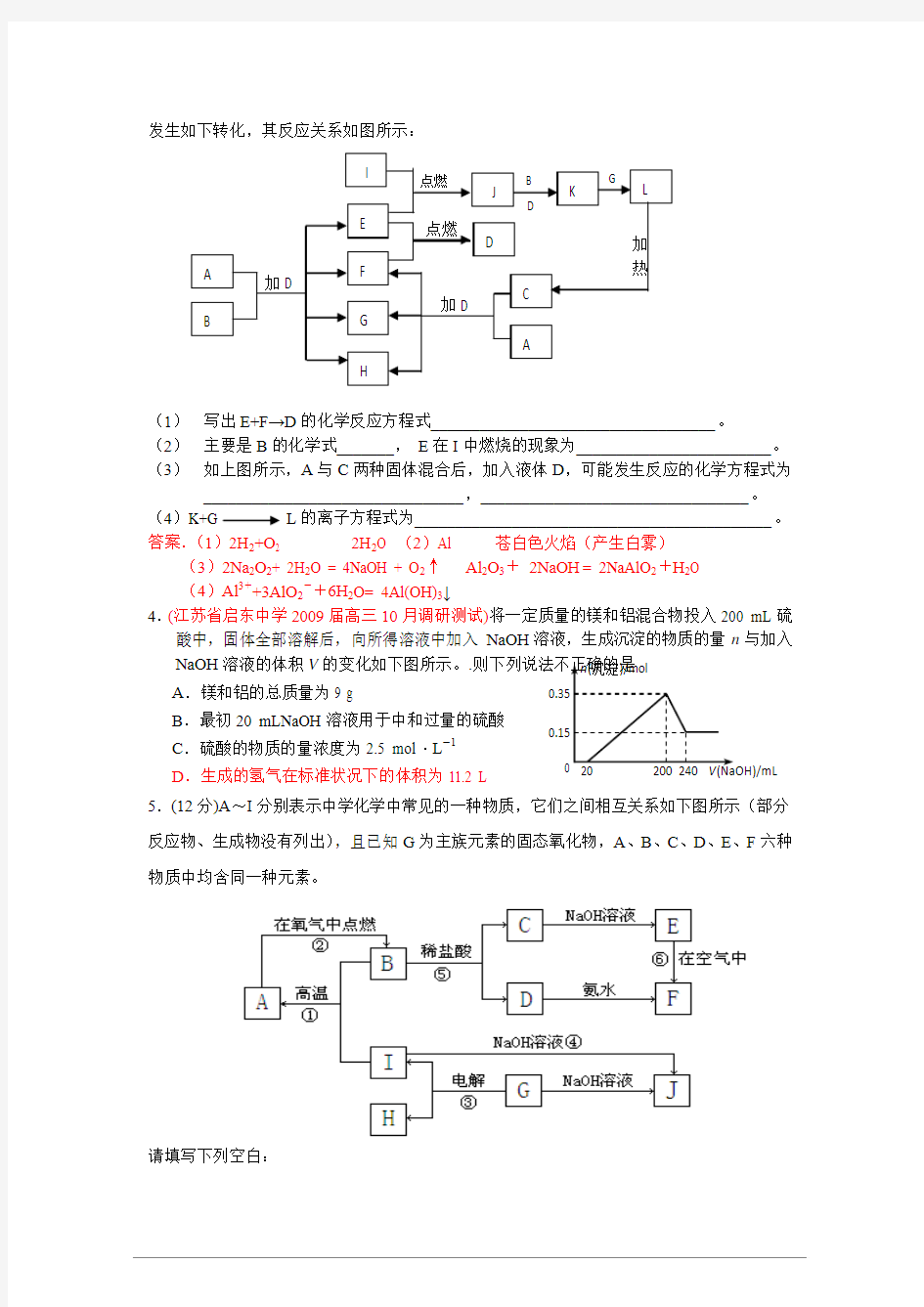
3.(江苏省启东中学2009届高三10月调研测试)(8分)下列框图中的每一个字母都是中学化学中常见的物质,所有物质均由短周期元素组成,其中B 、C 、G 、K 、L 都含有同一种元素。B 、E 、F 、I 为单质。常温常压下D 为液体,E 、F 、I 为气体,F 是空气的主要成分之
一。C 由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽。这些物质之间有可能
发生如下转化,其反应关系如图所示:
(1) 写出E+F→D 的化学反应方程式___________________________________。
(2) 主要是B 的化学式_______, E 在I 中燃烧的现象为________________________。
(3) 如上图所示,A 与C 两种固体混合后,加入液体D ,可能发生反应的化学方程式为
________________________________,_________________________________。 (4)
K+G L 的离子方程式为____________________________________________。 答案.(1)2H 2+O 2 2H 2O (2)Al 苍白色火焰(产生白雾)
(3)2Na 2O 2+ 2H 2O = 4NaOH + O 2↑ Al 2O 3+ 2NaOH = 2NaAlO 2+H 2O
(4)Al 3++3AlO 2-+6H 2O= 4Al(OH)3↓
4.(江苏省启东中学2009届高三10月调研测试)将一定质量的镁和铝混合物投入200 mL 硫
酸中,固体全部溶解后,向所得溶液中加入NaOH 溶液,生成沉淀的物质的量n 与加入
NaOH 溶液的体积V 的变化如下图所示。.A .镁和铝的总质量为9 g
B .最初20 mLNaOH 溶液用于中和过量的硫酸
C .硫酸的物质的量浓度为2.5 mol ·L -1
D .生成的氢气在标准状况下的体积为11.2 L 5.(12分)A ~I 分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G 为主族元素的固态氧化物,A 、B 、C 、D 、
E 、
F 六种物质中均含同一种元素。
请填写下列空白:
(1)A 、B 、C 、D 、E 、F 六种物质中所含同一种元素在周期表中位置第_______周期、第_______族 ;
(2)写出反应①的化学方程式___________ _________;
(3)写出反应④的离子方程式_____________ _______;
(4)写出反应③的电极方程式:
阳极:_______________ _____ 阴极:____________ __________
(5)从能量变化的角度看,①②③反应中属于△H <0的反应是___________。(填序号) 答案.(共9分)
⑴第四周期、第Ⅷ族 共2分
⑵8Al +3Fe 3O 44Al 2O 3+9Fe 共2分
⑶ 2Al +2OH -+2H 2O =2AlO 2-+3H 2↑ 共2分
⑷阳极:3O 22--6e -=3O 2↑;阴极:2Al 3++6e -=2Al 共2分
(5)①② 共1分
6. 用铝粉和四氧化三铁粉末配成的铝热剂,分成两等份:一份在高温下恰好反应,再与足
量稀硫酸反应,生成氢气a L ;另一份直接放入足量的氢氧化钠溶液中充分反应,在同
条件下生成氢气b L ,则a ∶b 为:
A .1∶1
B .3∶4
C .4∶3
D .8∶9
7.(哈尔滨五中2009届高三9月考) (6分)将1.05g 铝和过氧化钠的混合物放入一定量的水
中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L 一1的盐酸,可恰好使反应过程
中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
答案.解:有关反应为:2Na 2O 2+2H 2O=4NaOH+02↑
2Al+2NaOH+2H 2O=2NaAl02+3H 2↑
NaAlO 2+HCl+H 20=Al(OH)3↓+NaCl
A1(OH)3+3HCl 3+3HCl=AlCl 3+3H 20
最终溶液中所含溶质为NaCl 、AlCl 3,
设NaCl 、AlCl 3的物质的量分别为x mol ,y mol ,则Na 202、Al 的物质的量分别为 ,依题意有:
mol ,mol 2y x g m g O Na m y x y x g y x 27.0)Al (8.7)(mol 01.0mol 02.005.0305.12778222==∴==?????=+=?+?解出
8.(哈尔滨五中2009届高三9月考)(6分)下图表示的反应关系中,部分产物被略去,已知
1mol白色固体粉末X完全分解后,恢复到室温,生成白色固体A,无色液体B,无色气
体C各1mol,E、X、G的焰色反应均为黄色。
请回答下列问题:
(1)写出下列物质的化学式:X:G:D:
(2)写出G与C反应的化学方程式
(3)写出X+E→A的离子方程式
答案.(1)X:NaHC03G:NaAIO2D:Al(OH)3
(2)NaAlO2+C02+2H20=NaHCO3+Al(OH)3↓
(3)HCO3-+0H一=CO32-+H20
9.(杭州儒林·育英高复学校9月考)(8分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
试回答:
(1)若X是强氧化性单质,则A不可能是。
a.S b.N2c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色
沉淀,则B的化学式为;C溶液在贮存时应加入少量X,理由是(用必要的
文字和离子方程式表示)。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应
生成B,则B的化学式为,X的化学式可能为(写出不同类物质)或,
反应①的离子方程式为或。
答案
(1)de(1分)
(2)FeC13(1分);2Fe3++Fe=3Fe2+(1分)防止Fe2+被氧化(1分)
(3)A1(OH)3(1分);NaOH(或KOH)(1分);HC1(或其他强酸)(1分);
A13++3OH-=A1(OH)3↓(1分);A1O2- + H++H2O=A1(OH)3↓(1分)
(其他正确答案可参照本标准给分)
10.(杭州儒林·育英高复学校9月考)(10分)用如图所示装置(夹持仪器省略)进行实验,
将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是。
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是
;
继续通气体于C 中,足够长的时间后,发现C 中溶液的颜色消失,这是因为在溶液中I 2能被Cl 2氧化为HIO 3,写出该反应的离子反应方程式 。
(4)若A 为浓氨水,B 为生石灰,C 中盛有AlCl 3溶液,旋开E ,足够长的时间后,C 中的现象是 ,C 中发生反应的离子方程式为 。
(5)该题图示装置有多种用途,请举一例(除题中之外)填空:A ,B 为 ;C 中盛 ,其目的为 。
答案.(共10分)(1)防倒吸 (1分)
(2)2H 2S + O 2 == 2S ↓ + 2 H 2O (1分)
(3)有气泡出现,同时溶液由无色变成蓝色 (1分);
6H 2O +I 2 +5Cl 2==2IO 3- + 10Cl - +12H + (1分)
(4)有白色沉淀生成,Al 3++3NH 3.H 2O ==Al(OH)3 ↓+ 3NH 4+ (每空1分,共2分)
(5)合理则给分(每空1分,共4分)
11.(四川南充市2009高三9月考)将5.4 g Al 投入200 mL 2-1
mol L
的某溶液中有氢气产生,充分反应后有金属剩余,该溶液可能为( A )
A .HCl 溶液
B .24H SO 溶液
C .3HNO 溶液
D .2Ba(OH)溶液 12.(四川南充市2009高三9月考)A 、B 、C 、D 、
E 均为中学化学常见的纯净物,B 为自然界中含量最多的液体,它们之间有如下的反应关系:
(1)常温下,若A 为气态单质,c 为非金属氧化物,A 、C 均能使品红溶液褪色,相对分子质量E>D ,则该反应的反应方程式为:__________________,检验D 中阴离子所用试剂为: 。
(2)若A 为短周期的金属单质,D 为气态单质,C 溶液呈
酸性或强碱性时,该反应都能进行。写出反应的离子方
程式:
(3)若A 、c 均为化合物,E 为白色沉淀,c 为引起温室效应的主要气体,写出E 可能的物质的化学式(写两种): , 。写出生成E 的一个离子方程式: 。
答案
(1) 22224C1+SO +2H O=H SO +2HCl ;
3AgNO 溶液,稀3HNO (只答3AgNO 溶液不给分)
(2) +3+22A1+6H =2A1+3H ↑
-2-
222A1+2OH +2H O=2A1O -+3H ↑
(3) 233H SiO Al(OH)
2-2-322233
SiO +CO +H H SiO +CO O =↓ 或-
-22233AlO +CO +2H O=Al(OH)+HCO ↓
或-
2-222332A1O +CO +3H O=2AI(OH)+CO ↓ (其他合理答案也可以)
【化学】化学 铝及其化合物推断题的专项 培优易错试卷练习题含答案
【化学】化学铝及其化合物推断题的专项培优易错试卷练习题含答案 一、铝及其化合物 1.铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4·7H2O)和氧化铝,其工艺流程如图: 回答下列问题: (1)滤渣1的成分是___,举例说明滤渣2的用途___。 (2)用离子方程式表示溶液A加入过量铁粉的目的是___。 (3)写出由滤液1生成滤液2的离子方程式___。 (4)过程1、2、3均涉及分离操作,所需玻璃仪器有___。 (5)由溶液B得到绿矾的具体操作为___、过滤、洗涤和干燥。 (6)过程3需要加入的试剂A是___,写出此过程的离子方程式___。 【答案】Fe2O3、FeO 制备硅胶,作干燥剂将Fe3+全部还原为Fe2+ AlO2-+4H+= Al3++2H2O 漏斗、烧杯和玻璃棒蒸发氨水 Al3++3NH3﹒H2O= Al(OH)3↓+3NH4+ 【解析】 【分析】 Al2O3属于两性氧化物,Fe2O3、FeO都是碱性氧化物,SiO2属于酸性氧化物,因此,矿石中的Al2O3和SiO2能溶于氢氧化钠溶液,Fe2O3、FeO溶于氢氧化钠溶液,滤渣1的成分是 Fe2O3、FeO;滤液1中的溶质有NaAlO2和Na2SiO3,加入过量盐酸后,AlO2-转化为Al3+,SiO32-转化为H2SiO3的白色胶状沉淀,滤液2的主要溶质是AlCl3,滤渣2的成分是H2SiO3,可用于制备硅胶,作干燥剂;过程3的作用是将溶液中的Al3+转化为Al(OH)3沉淀,应加入碱溶液;Fe2O3、FeO都能溶于稀硫酸,分别得到Fe2(SO4)3和FeSO4,溶液A的溶质有 Fe2(SO4)3和FeSO4,加入过量铁粉,将Fe3+全部还原为Fe2+,溶液B为FeSO4。 【详解】 (1)由分析可知滤渣1的成分是Fe2O3、FeO;滤渣2的成分是H2SiO3,可用于制备硅胶,作干燥剂,故答案为:Fe2O3、FeO;制备硅胶,作干燥剂; (2) Fe2O3、FeO都能溶于稀硫酸,分别得到Fe2(SO4)3和FeSO4,溶液A的溶质有Fe2(SO4)3和FeSO4,加入过量铁粉,将Fe3+全部还原为Fe2+,反应的离子方程式为:2 Fe3++Fe=3 Fe2+, 故答案为:将Fe3+全部还原为Fe2+; (3)由滤液1生成滤液2的过程为AlO2-转化为Al3+,离子方程式为:AlO2-+4H+= Al3++2H2O,故答案为:AlO2-+4H+= Al3++2H2O; (4)过程1、2、3均涉及到的分离操作是过滤,所需玻璃仪器有漏斗、烧杯和玻璃棒,故答案为:漏斗、烧杯和玻璃棒; (5)溶液B得到绿矾的具体操作为蒸发、过滤、洗涤和干燥,故答案为:蒸发; (6)过程3的作用是将溶液中的Al3+转化为Al(OH)3沉淀,应加入碱溶液,由于Al(OH)3能溶
高二化学 学业水平测试考点复习 考查点6 从铝土矿到铝合金 苏教版
考查点6 从铝土矿到铝合金 教学目标 1. 铝及其重要化合物的主要物理性质和应用 2.铝、氧化铝、氢氧化铝的化学性质 教学重、难点 铝、氧化铝、氢氧化铝的化学性质 教学过程 一、金属铝的性质 地壳中含量最多的金属元素是 __ ;含量最多的非金属元素是 __ 。 铝是一种_________色的金属,硬度_________,密度___________,熔沸点__________,导电和导热性能_______________ 1、与非金属单质的反应 ①与氧气反应常温下易生成致密的氧化膜,在空气中具有良好的 _ 性。 与氧气在高温下的反应: __ ②与氯气化合: ___ 2、与金属氧化物反应(铝热反应) 焊接钢轨(《必修1》P67)时的反应: __ _ 3、与非氧化性酸(如:稀盐酸)的反应: ___ _________ 4、与氧化性酸的反应:在浓硫酸、浓硝酸里发生 5、与强碱(如氢氧化钠)的反应: _____ 6、与盐溶液的反应(与铜的置换反应): _ 二、氧化铝的性质(两性氧化物) 1、与强酸(如稀盐酸)的反应: _ 2、与强碱(如氢氧化钠)的反应: 三、氢氧化铝的性质(两性氢氧化物) 1、与强酸(如稀盐酸)的反应: 2、与强碱(如氢氧化钠)的反应: 注意:氢氧化铝不能溶解在氨水中。 3、不稳定性(受热易分解): ______
四、铝的冶炼――电解法(见《必修1》P62-63) 方程式:_______________________________________________________ 【归纳】铝三角的转换关系 Al 3+←???加酸Al ???→加碱 AlO 2- Al 3+←???加酸Al 2O 3???→加碱 AlO 2- Al 3+酸碱Al(OH)3酸碱AlO 2- 【练习】 1、①相同物质的量的钠、镁、铝与足量的稀盐酸反应时放出的氢气的体积比为_________。 ②相同质量的钠、镁、铝与足量的稀盐酸反应时放出的氢气的体积比为____________。 ③分别将0.3mol 的钠、镁、铝投入100mL 1mol/l 的硫酸溶液中,产生的氢气的体积比为____________。 2、将一块镁铝合金先溶解在盐酸中,恰好反应完全,再加入过量的NaOH 溶液,发生反应的离子方程式依次是⑴ _ ; ⑵ _ ; ⑶ _ ; ⑷ _ ;⑸ _ ; 3、下列为铝或铝合金的各种用途,在后面横线上写出所根据的性质: ⑴制造飞机或汽车外壳 ; ⑵作为储存浓硫酸的容器 ; ⑶制造各种日用炊具 ; ⑷铝热法冶炼金属 ; ⑸造电线电缆 ; ⑹制造包装用的铝箔 。 4、下列五个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量,请从A ~E
钠、铝及其化合物练习题
钠、铝及其化合物练习题 1.下列物质的保存方法正确的是() ①少量金属钠保存在冷水中②浓硝酸盛放在棕色试剂瓶中③少量金属钾保存在煤油中④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中⑤碳酸钠固体保存在带橡胶塞的细口瓶中 A.③④B.①③④ C.②③④D.③④⑤ 2.将0.1 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)() ①Na2O2②Na2O③Na2CO3④NaCl A.①>②>③>④B.①>②>④>③ C.①=②>③>④D.①=②>③=④ 3.下列叙述中正确的是() A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 B.向Na2CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶2 C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 4.120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是() A.2.0 mol/L B.1.5 mol/L C.0.18 mol/L D.0.24 mol/L 5.相同温度下,在甲、乙、丙、丁四个烧杯中分别盛有等体积、等物质的量浓度的NaOH不饱和溶液,分别加入Na、Na2O、Na2O2、NaOH并恢复至原温度恰好都形成NaOH的饱和溶液,则甲、乙、丙、丁四个烧杯中加入的固体质量的大小顺序是() A.丁>丙>乙>甲B.丁>甲>乙>丙 C.甲=丁>乙=丙D.丁<丙<乙<甲 6.不能按(“→”表示反应一步完成)关系转化的是() 7.下列物质的转化在给定条件下能实现的是() ①Al2O3――――→ NaOH(aq) △ NaAlO2(aq)――→ CO2 Al(OH)3 ② S―――→ O2/点燃 SO3――→ H2O H2SO4 ③饱和NaCl(aq)――――→ NH3,CO2 NaHCO3――→ △ Na2CO3 ④Fe2O3――→ HCl(aq) FeCl3(aq)――→ △ 无水FeCl3 ⑤MgCl2(aq)――→ 石灰乳 Mg(OH)2――→ 煅烧 MgO A.①③⑤B.②③④ C.②④⑤D.①④⑤ 8.某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴入少量氢氧化钠,无明显变化; (2)继续滴加NaOH溶液,白色沉淀;(3)滴入过量的氢氧化钠,白色沉淀明显减少。实验小组经定量分析,做出如下沉淀与滴入氢氧化钠体积的关系: 下列说法错误的是() A.该未知溶液中至少含有3种阳离子 B.滴加的NaOH溶液的物质的量浓度为5 mol/L C.若另一种离子为二价阳离子,则a=10 D.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
最新《从铝土矿到铝合金》练习
《从铝土矿到铝合金》练习 班级________________ 姓名____________________ 一、选择题 1.下列物质中一定属于纯净物的是( ) A 刚玉 B 铝土矿 C 偏铝酸钠 D 、含铝52.94%的Al 2O 3样品 2.下列有关厨房铝制品的使用中,你认为合理的是( ) A 盛放食醋 B 烧煮开水 C 用金属丝擦表面的污垢 D 用碱水洗涤 3.向足量的浓氢氧化钠溶液和足量的盐酸溶液中分别投入铝粉,充分反应后放出等量的氢气,则两个溶液中参加反应的铝的质量之比为( ) A 1:3 B 3:1 C 1:1 D 1:2 4.下列各组物质混合反应后, 不能得到A1Cl 3的是( ) A 氧化铝和盐酸 B 铝和氯气 C 氧化铝和烧碱溶液 D 氢氧化铝和盐酸 5.将Mg 、Al 和Fe 分别投入质量相等且过量的稀硫酸中,反应结束后,各溶液的质量仍相等,则投入的Mg 、Al 和Fe 三者的质量关系 ( ) A Mg >Al >Fe B Fe >Al >Mg C Al >Mg >Fe D Mg =Al =Fe 6.从铝土矿中提炼Al 2O 3所需试剂是( ) A.NaOH 溶液 B.盐酸 C.NaOH 溶液、盐酸 D.水 7.某氧化物不溶于水,溶于熔化的NaOH 中,生成易溶于水的化合物,向稀盐酸中滴入该溶液,有白色沉淀生成,则原氧化物是( ) A.Al 2O 3 B.MgO C.Fe 2O 3 D.Al(OH)3 8.下列离子方程式错误的是( ) A.氢氧化铝与盐酸反应 Al(OH)3 + 3H +=Al 3+ + 3H 2O B.氧化铝溶于氢氧化钠溶液 Al 2O 3 + 2OH -=2AlO 2—+ H 2O C.碘化钾溶液中滴入溴水 2I - + Br 2 = I 2 + 2Br - D.NaAlO 2溶液中通入过量CO 2 2AlO 2—+ CO 2 +3H 2O=== 2Al(OH)3↓+ CO 32— 9.下列金属冶炼的反应原理,错误的是( ) A 、2NaCl(熔融) →通电 2Na + Cl 2↑ B 、Al 2O 3 + 3H 2 2Al + 3H 2O C 、Fe 3O 4 + 4CO 3Fe + 4CO 2 D 、MgCl 2 →通电 Mg + Cl 2↑ 10.某无色透明溶液能与铝作用放出氢气,且溶液中的离子能大量共存的是( ) A K +、NO 3-、OH -、Cl - B Cu 2+、SO 42-、H +、Na + C H +、Ba 2+、Mg 2+、NO 3- D NH 4+、MnO 4-、H +、K + 11.把Al 和Fe 3O 4粉配成铝热剂,分成两等份,前一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,后一份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成气体的物质的量之比为 ( ) A 1︰3 B 9︰8 C 3︰4 D 4︰3 12.下列离子方程式书写正确的是 ( ) A 、硫酸铝中加入过量氨水:Al 3++3OH -=Al(OH)3↓ B 、氢氧化铝跟盐酸反应:2Al(OH)3+6H + = 2Al 3++6H 2O C 、硫酸铜与氢氧化钡溶液反应:Ba 2++SO 42- = BaSO 4↓
《从铝土矿到铝合金》教案(苏教版必修)
第一单元 第3课时铝的性质 一、学习目标 1.通过对铝的性质的实验探究,掌握铝与氧化物、酸、碱溶液的反应,锻炼学生的实验能力和观察能力。 2.了解铝制品的相关使用知识,体验化学与生活的紧密联系。 二、教学重点及难点: 教学重点:铝的化学性质。 教学难点:铝与强碱溶液的反应、铝的钝化。 三、设计思路: 铝是生活中常见的金属材料,所以本节内容的设计紧紧抓住铝在日常生活中的应用展开。首先根据常见的铝制品和铝在高科技上的应用归纳出铝的物质性质,再利用铝制品和铁制品的腐蚀程度不同、铝锅能否经常用金属清洁球或煤渣擦亮、铝桶能否放酸液等生活问题创设情境,通过“设置疑问-实验探究-理性认识的过程”使学生清晰的掌握铝的相关知识。 四、教学设计 【设置情境】 (图1)铝合金具有密度小、导热性好、易于成形、价格低廉等优点,已广泛应用于航空航天、交通运输、轻工建材等部门,是轻合金中应用最广、用量最多的合金。 (图2)这是一架播音747飞机, 铝合金是飞机的主要用材,用量占70%~80%,其中仅铝合金铆钉一项就有40~150万个,用铝约22吨,据预测,2010年全球航空航天铝材的消费量可达60万吨,年平均增长率约为4.5%。 (图3)这是一款新型轿车,在广告中的卖点是“宽敞的空间”和“全铝合金引擎”。1991-1999年铝及铝合金在汽车上的应用翻了一番,预计到2005年还将再翻一番。预计2005年美国汽车用铝及铝合金将超过130kg/辆,西欧将达到119kg/辆。 【提问】请大家思考下日常生活中铝还有什么应用?主要利用了铝的哪些物理性质?
【板书】一、铝的物理性质及用途: 飞机制造----铝的密度小 用作导线----良好的导电性 铝制炊具----良好的导热性 用作包装----良好的延展性 【提问】我们知道铝是地壳里含量最丰富的金属元素,但是它在自然界中是以游离态还是化合态存在的?说明了铝的性质如何? 【过渡】铝的性质很活泼。根据金属活动性顺序表,铝比铁活泼,我们来看看现实中铝和铁制品的使用情况。请同学分别来展示你们的调查记录: 【学生活动】先将活动地点、活动时间、活动情况作简要表述,然后将记录内容投影出来。 (投影内容) 【设疑一】这个与金属活动顺序不符。铝怎么不像铁那样容易被空气腐蚀?铝难道不能被空气中的氧气氧化?你们能设计一个简单实验,来确认铝有没有被氧气氧化吗? 【学生活动】互相讨论,设计方案。教师评价,确定实验方案。 【学生实验】用砂纸打磨铝条表面,观察表面颜色变化,然后将铝条在空气中放置一会儿。 【设问】1.为何铝条在打磨前后颜色会有变化?在打磨后铝表面是什么物质呢? 2.放置后铝片表面颜色变化说明铝的活泼性如何? 【追问】铁在空气中被氧化表面生成Fe2O3而生锈腐蚀,且生锈后内部的铁被腐蚀的程度和速度都会越来越严重,那么,Al在空气中同样也被氧化表面生成了Al2O3,Al为何没有继续被氧化而一直腐蚀下去,越来越严重呢?两者好像有点矛盾啊。
铝及其化合物同步测试
高一化学同步测试(A) 无锡智学堂爱行教育备课组 第二节铝及其化合物 一、选择题:(本题共6小题,每小题3分,共18分,每小题只有一个正确答案) 1.对氧化铝的分类中正确的是()A.酸性氧化物B.碱性氧化物 C.两性氧化物D.不成盐氧化物(像CO一样) 2.氢氧化铝可作为治疗某种胃病的内服药,这是利用了氢氧化铝的哪个性质()A.酸性B.碱性C.两性D.氧化性 3.下列物质露置在空气中,质量会减轻的是()A.NaOH B.Na 2O2C.无水CaCl2D.Na2CO3·10H2O 4.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是() A.无水硫酸铜 B.硫酸亚铁C.食盐D.生石灰 5.下列操作中,溶液的颜色不发生变化的是()A.碳酸氢钠溶液中滴加稀盐酸B.硫酸铁溶液中滴加硫氰化钾溶液 C.碘水中滴加淀粉碘化钾溶液D.氯化铁溶液中加入还原性铁粉 6.下列关于“焰色反应”的理解正确的是()A.只有金属单质才有焰色反应 B.只有金属化合物才有焰色反应 C.只有某些金属或其化合物才有焰色反应 D.只有金属离子才有焰色反应 二、选择题(共10小题,每小题4分,计40分,每小题有1—2个正确答案,只有一个正确选项 的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。) 7.下列关于碳酸钠和碳酸氢钠的比较中,正确的是() A .二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 B .二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性 C.二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同
铝及其化合物测试题及答案
铝及其化合物 一、单项选择题(本大题共6小题,每小题4分,共24分) 1.下列操作所得物质为纯净物的是() A.将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体 B.向NaAlO2溶液中加入过量的AlCl3溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的Al(OH)3固体 C.把铝块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体 D.把AlCl3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体 【解析】A项,混有NaOH固体;B项,灼烧得到的是Al2O3;C项,得到的是Al(OH)3和Al2O3。 【答案】 D 2.(2013届济宁市高三上学期期末考试)某氧化物X难溶于水,能与烧碱反应,生成易溶于水的化合物Y,将少量Y溶液滴入盐酸中无沉淀生成,则X是 () A.SiO2B.Al2O3 C.MgO D.CuO 【解析】C项MgO不能溶于烧碱,不正确;少量Y滴入盐酸不能形成沉淀,Al2O3符合题意,A项不正确;B项正确;D项CuO不能溶于烧碱,不正确。 【答案】 B 3.下列说法中不正确的是() A.铝是地壳里含量最多的金属元素 B.在常温下,铝不能与氧气反应 C.Cl-、H+、Na+均能与Al3+共存 D.使AlCl3溶液中Al3+全部沉淀出来的最佳试剂是氨水,而不是NaOH溶液 【解析】常温下,铝与O2形成致密氧化膜,属于化学反应。 【答案】 B
4.下列离子方程式书写正确的是() A.氯化铝溶液中滴入过量浓氨水:Al3++4NH3·H2O===AlO-2+4NH+4+2H2O B.铝和氢氧化钠溶液反应:Al+2OH-===AlO-2+H2↑ C.Al2O3溶于强碱:Al2O3+OH-===2AlO-2+H2O D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO2-4完全沉淀:2Ba2++NH+4+Al3++2SO2-4+4OH-===Al(OH)3↓+NH3·H2O+2BaSO4↓【解析】A项,不能生成AlO-2;B项,原理错误且电荷不守恒;C项,没有配平。 【答案】 D 5.(2013届中山市高三质检)在可以溶解氧化铝的溶液中,一定能大量共存的离子组是() A.NH+4、Na+、S2-、SO2-3 B.K+、AlO-2、I-、SO2-4 C.Ca2+、Fe2+、NO-3、Br- D.Na+、K+、Cl-、SO2-4 【解析】可以溶解氧化铝的溶液可能呈强碱性或强酸性。A项强碱性NH+4不能存在,强酸性条件下S2-与SO2-3不能共存;B项强酸性条件下AlO-2不能大量存在;C项强酸性条件下Fe2+与NO-3不能共存,强碱性条件下Ca2+、Fe2+不能存在。 【答案】 D 6.(2013届汕头市高三第一次模拟)有一块镁铝合金,其中镁与铝的质量比是8∶9。加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是() 【解析】镁与铝的质量比是8∶9,则物质的量之比是1∶1,NaOH溶液至过量后Al(OH)3完全溶解,只有Mg(OH)2,B错;等物质的量的Mg(OH)2与Al(OH)3的质量之比是58∶78,即剩余的Mg(OH)2的质量小于沉淀最大质量的1/2,排除C、D,选A。
铝及其化合物练习题及答案
铝及其化合物练习题及答案 【典型例题】 类型一:铝与NaOH溶液的反应 例题1 甲、乙两烧杯中各盛有100 mL 3 mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为1∶2,则加入铝粉的质量为()A.5.4 g B.3.6 g C.2.7 g D.1.8 g 【答案】A 【解析】2Al+6HCl=2AlCl3+3H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 由反应方程式可知,若在等物质的量浓度的盐酸和NaOH溶液中分别加入足量铝,反应时产生H2的体积之比1∶3,现在产生H2的体积之比为1∶2,说明铝粉的量相对于盐酸来说是过量的,对于NaOH来说是不足量的,所以与盐酸反应的铝粉质量为2.7 g,与NaOH 反应的铝粉质量为5.4 g。 【总结升华】因为铝与NaOH溶液反应是一个较为特殊的反应,所以当铝与NaOH溶液在同一题目中出现时,往往要用到2Al+2NaOH+2H2O=2NaAlO2+3H2↑这一关系来解。 举一反三: 【变式1】取两份等质量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同情况下产生的气体体积之比是() A.1∶1 B.1∶2 C.1∶3 D.3∶2 【答案】A 【变式2】下列关于金属元素特征的叙述正确的是() (1)金属元素的原子只有还原性,离子只有氧化性;(2)金属元素在化合物中只显正价;(3)金属性越强的元素相应的离子氧化性越弱;(4)价电子越多的金属原子金属性越强;(5)离子化合物一定含金属元素 A、(1)(2)(3) B、(2)(3) C、(1)(4)(5) D、全部 【答案】B 【解析】(1)对于变价金属中,较低价态的金属离子既有氧化性,又有还原性,如Fe2+。 (2)金属元素的原子只具有还原性,故在化合物中只显正价。(4)金属性的强弱要看失电子的难易。(5)离子化合物不一定含金属元素,如NH4Cl。 类型二:Al2O3、Al(OH)3的性质与制法 例题2 既能与盐酸反应又能与氢氧化钠溶液反应的化合物是() ①Al ②NaHCO3③Al2O3④Mg(OH)2⑤Al(OH)3 A.①②③⑤B.①④⑤C.②③⑤D.①③④ 【答案】C 【解析】注意审题,题目要求是“化合物”,防止错选A。 特别提示:两性物质是指既能与酸反应又能与碱反应生成盐和水的化合物。两性氧化物有Al2O3、ZnO等,两性氢氧化物有Al(OH)3、Zn(OH)2等。定义中的酸指非氧化性强酸溶液,碱指强碱溶液,其实质是与H+和OH―反应。 弱酸的铵盐[如(NH4)2CO3、(NH4)2S等]、弱酸的酸式盐(如NaHCO3)均既能与强酸(H+)反应又能与强碱(OH―)反应,但它们不属于两性物质。 举一反三: 【变式1】氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是()
2020-2021备战高考化学铝及其化合物推断题综合练习题含答案解析
2020-2021备战高考化学铝及其化合物推断题综合练习题含答案解析 一、铝及其化合物 1.为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: (1)第①步Cu与混酸反应的离子方程式为________________。得到滤渣1的主要成分为___________。 (2)第②步中加入H2O2的作用是__________________,使用H2O2的优点是_________;调溶液pH的目的是_________________。 (3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________。(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案: 上述三种方案中,_______方案不可行,原因是________________; 从原子利用率角度考虑,_______方案更合理。 (5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-→ CuY2-+ 2H+。写出计算CuSO4·5H2O质量分数的表达式ω= __________________ 。 【答案】Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O或3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O Au、Pt 将Fe2+氧化为Fe3+不引入杂质,对环境无污染使Fe3+、Al3+沉淀除去加热滤液2,经过蒸发、冷却、结晶、过滤,最终制得硫酸铜晶体甲所得产品中含有较多 Fe2(SO4)3杂质乙 3 102505 c b a - ???? × 100% 【解析】 【分析】 【详解】 (1)Cu与混酸反应的实质是与H+、NO3-反应,随反应进行离子浓度逐渐减小,所以离子方程式为Cu + 4H++ 2NO3-=Cu2++ 2NO2↑+ 2H2O,3Cu + 8H++ 2 NO3-=3Cu2++ 2NO↑+ 4H2O,Au、Pt不与混酸反应,所以滤渣的主要成分是Au、Pt; (2)加过氧化氢的目的是把亚铁离子氧化成铁离子,方便除去;而且加入过氧化氢不会引入新的杂质且无污染;调节溶液的pH目的是使Fe3+、Al3+沉淀除去;
苏教版高中化学必修一测试题:3-2从铝土矿到铝合金.docx
高中化学学习材料 唐玲出品 第二单元从铝土矿到铝合金 一、选择题 1.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 ( ) A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠 答案 C 2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。 反应中镁和铝的( ) A.物质的量之比为3∶2 B.质量之比为3∶2 C.摩尔质量之比为2∶3 D.反应速率之比为2∶3 解析由图像可知,两个反应中生成的氢气一样多,说明两种金属提供的电子数目一样多,则镁、铝的物质的量之比为3∶2,质量之比为4∶3,故A项正确,B项错误。镁、铝的摩尔质量之比为8∶9,C项错。由图像镁、铝与硫酸反应需要的时间之比为2∶3,则二者的速率之比为3∶2,D项错。 答案 A 3.将下列各组物质混合后,溶液中一定有沉淀生成的是( ) A.Al2(SO4)3溶液与氨水 B.NaOH溶液与AlCl3溶液 C. NaAlO2溶液与盐酸 D.铝与NaOH溶液 答案 A 4.向30 mL 1 mol·L-1的AlCl3溶液中逐渐加入浓度为4 mol·L-1的NaOH溶液,若产生0.78 g白色沉淀,则加入的NaOH溶液的体积可能为( ) A.3 mL B.7.5 mL C.15 mL D.17.5 ml 解析已知n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝
的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量。 由两者反应的离子方程式知Al 3++3OH -===Al(OH)3↓,Al(OH)3+OH -===AlO - 2+2H 2O 当碱的量不足时,则V (NaOH)=7.5 mL ;当碱过量时,则V (NaOH)=0.03×3+0.024 L =0.027 5 L =27.5 mL 。 答案 B 5.Al 、Fe 、Cu 都是重要的金属元素。下列说法正确的是 ( ) A .三者对应的氧化物均为碱性氧化物 B .三者的单质放置在空气中均只生成氧化物 C .制备AlCl 3、FeCl 3、CuCl 2均不能采用将溶液直接蒸干的方法 D .电解AlCl 3、FeCl 3、CuCl 2的混合溶液时阴极上依次析出Cu 、Fe 、Al 解析 A 项,Al 2O 3为两性氧化物;B 项,Cu 在空气中的CO 2和H 2O(g)的作用下与O 2反应生成Cu 2(OH)2CO 3;C 项,三种盐均为强酸弱碱盐,加热时都水解,且生成易挥发的HCl ,随着水分和HCl 的挥发,蒸干时都得到金属氧化物和其氢氧化物的混合物;D 项,电解AlCl 3溶液阴极上的产物为H 2和Al(OH)3。 答案 C 6.将一定质量的Mg 和Al 混合物投入500 mL 稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH 溶液,生成沉淀的物质的量与加入NaOH 溶液的体积关系如下图所示。则下列说法正确的是 ( ) A .Mg 和Al 的总质量为8 g B .硫酸的物质的量浓度为5 mol ·L -1 C .生成的H 2在标准状况下的体积为11.2 L D .NaOH 溶液的物质的量浓度为5 mol ·L -1 解析 由图可知,固体中含有0.15 mol 的Mg 和0. 2 mol 的Al ,所以总质量为9 g ;与硫酸反应生成的氢气的体积应为(0.15 mol +0.3 mol)×22.4 L ·mol -1=10.08 L ;在加入240 mL NaOH 溶液时,Al(OH)3恰好全部转化为NaAlO 2,所以氢氧化钠溶液的浓度为 0.35-0.15mol 240-200mL ×10-3L ·mL -1=5 mol ·L -1 。 答案 D
从铝土矿到铝合金
专题三 从矿物到基础材料 第一单元 从铝土矿到铝合金 一、从铝土矿中提取铝 (一)氧化铝(Al 2O 3) 氧化铝是一种高沸点(2980℃)、高熔点(2054℃)、高硬度的白色化合物,常用作耐火材料。刚玉的主要成分是α-氧化铝,硬度仅次于金刚石。 1.与碱的反应(与强碱NaOH ) Al 2O 3+2NaOH =2NaAlO 2+ H 2O 2.与强酸的反应(H 2SO 4) Al 2O 3+3H 2SO 4=Al 2(SO 4)3+3H 2O 3.两性氧化物:既可以与酸反应又可以与碱反应生成盐和水的氧化物。 知识拓展 1.偏铝酸钠(NaAlO 2)的性质 (1)往偏铝酸钠溶液中通入CO 2 NaAlO 2+CO 2+2H 2O=Al (OH )3↓+NaHCO 3 产生白色絮状沉淀,通入过量的CO 2,沉淀不溶解。 (2)往偏铝酸钠溶液中加HCl NaAlO 2+ HCl+H 2O=Al (OH )3↓+NaCl Al (OH )3+3 HCl =AlCl 3+3H 2O 加入少量盐酸,生成白色絮状沉淀,继续加入盐酸至过量,白色沉淀溶解。 2.氯化铝(AlCl 3)的性质 (1)往氯化铝溶液中通入氨气 AlCl 3+3NH 3+3H 2O= Al (OH )3↓+3NH 4Cl 产生白色絮状沉淀,通入过量的NH 3,沉淀不溶解。 (2)往氯化铝溶液中逐滴加氢氧化钠溶液 AlCl 3+ 3NaOH =Al (OH )3↓+3NaCl Al (OH )3+ NaOH =NaAlO 2+2 H 2O 加入少量NaOH 溶液,产生白色絮状沉淀,继续加入NaOH 溶液至过量,白色沉淀溶解。 (二)铝土矿中提取铝 制取金属铝的流程图如下: 流程图中所涉及到的化学反应: 1. Al 2O 3+2NaOH =2NaAlO 2+ H 2O 2. NaAlO 2+CO 2+2H 2O=Al (OH )3↓+NaHC O 3 3.2 Al (OH )3 Al 2O 3+3H 2O 4.2 Al 2O 3 4Al+3O 2↑ 电解 冰晶石
高中化学 《从铝土矿到铝合金第三课时》教案 苏教版必修
第1单元课时3 铝的性质 一、学习目标 1.通过对铝的性质的实验探究,掌握铝与氧化物、酸、碱溶液的反应,锻炼学生的实验能力和观察能力。 2.了解铝制品的相关使用知识,体验化学与生活的紧密联系。 二、教学重点及难点: 教学重点:铝的化学性质。 教学难点:铝与强碱溶液的反应、铝的钝化。 三、设计思路: 铝是生活中常见的金属材料,所以本节内容的设计紧紧抓住铝在日常生活中的应用展开。首先根据常见的铝制品和铝在高科技上的应用归纳出铝的物质性质,再利用铝制品和铁制品的腐蚀程度不同、铝锅能否经常用金属清洁球或煤渣擦亮、铝桶能否放酸液等生活问题创设情境,通过“设置疑问-实验探究-理性认识的过程”使学生清晰的掌握铝的相关知识。 四、教学设计 【设置情境】(ppt2) (图1)铝合金具有密度小、导热性好、易于成形、价格低廉等优点,已广泛应用于航空航天、交通运输、轻工建材等部门,是轻合金中应用最广、用量最多的合金。 (图2)这是一架播音747飞机, 铝合金是飞机的主要用材,用量占70%~80%,其中仅铝合金铆钉一项就有40~150万个,用铝约22吨,据预测,2010年全球航空航天铝材的消费量可达60万吨,年平均增长率约为4.5%。 (图3)这是一款新型轿车,在广告中的卖点是“宽敞的空间”和“全铝合金引擎”。 1991-1999年铝及铝合金在汽车上的应用翻了一番,预计到2005年还将再翻一番。预计2005年美国汽车用铝及铝合金将超过130kg/辆,西欧将达到119kg/辆。 【提问】请大家思考下日常生活中铝还有什么应用?(ppt3)主要利用了铝的哪些物理性质?【板书】一、铝的物理性质及用途:(ppt4) 飞机制造----铝的密度小 用作导线----良好的导电性 铝制炊具----良好的导热性 用作包装----良好的延展性
铝及其化合物练习题及答案
铝及其化合物练习题 1. 某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是() A. Cl-、SO42-、Na+、K+ B. K+、ClO-、Na+、NO3- C. HCO3-、Na+、NO3-、K+ D. NO3-、Ba2+、Cl-、NH4+ 2. 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液 反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为() A、1:1 B、1:2 C、1:3 D、1:4 3. 能用铝为原料来冶炼难熔的金属主要是因为() A.铝的密度小, 熔点较低 B.铝在空气中燃烧, 放出大量的热 C.铝在金属活动性顺序表排在较前面 D.铝具有还原性.发生氧化还原反应时放出大量的热 4. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是() A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠 5. 由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气在标准状况下为11.2L,则混合物中一定含有的金属是() A.锌 B.铁 C.铝 D.镁 6. 下列用途主要是体现铝的物理性质的是() ①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂 ⑦做防锈油漆⑧做合金用作飞机制造业材料⑨工业做热交换器 A.①②③④ B.③④⑥⑦⑧⑨ C.①③⑤⑦⑧⑨ D.①③②④⑥⑧ 7. 有关Al与NaOH溶液的反应的说法中,正确的是 ( ) A.铝是还原剂,其氧化产物是Al(OH)3 B.NaOH是氧化剂,其 还原产物是H2 C.铝是还原剂,H2O和NaOH都是氧化剂 D.H2O是氧化剂,Al 被氧化 8. 向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的 离子是( )
高三化学一轮复习铝及其化合物练习题
铝及其化合物练习题 一、选择题 1. 某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是() A. Cl-、SO42-、Na+、K+ B. K+、ClO-、Na+、NO3- C. HCO3-、Na+、NO3-、K+ D. NO3-、Ba2+、Cl-、NH4+ 2. 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢气的体积比为1:2,则第一份与第二份铝屑的质量比为() A、1:1 B、1:2 C、1:3 D、1:4 3. 能用铝为原料来冶炼难熔的金属主要是因为() A.铝的密度小, 熔点较低 B.铝在空气中燃烧, 放出大量的热 C.铝在金属活动性顺序表排在较前面 D.铝具有还原性.发生氧化还原反应时放出大量的热 4. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是() A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠 5. 由锌、铁、镁、铝四种金属中的两种组成的混合物10g,与足量的盐酸反应生成的氢气 在标准状况下为11.2L,则混合物中一定含有的金属是() A.锌 B.铁 C.铝 D.镁 6. 下列用途主要是体现铝的物理性质的是() ①家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂 ⑦做防锈油漆⑧做合金用作飞机制造业材料⑨工业做热交换器 A.①②③④ B.③④⑥⑦⑧⑨ C.①③⑤⑦⑧⑨ D.①③②④⑥⑧ 7. 有关Al与NaOH溶液的反应的说法中,正确的是 ( ) A.铝是还原剂,其氧化产物是Al(OH)3是氧化剂,其还原产物是H2 C.铝是还原剂,H2O和NaOH都是氧化剂是氧化剂,Al被氧化 8. 向某溶液中投入铝片后有大量H2放出,则溶液中不可能大量存在的离子是( ) + 9. 向NaAlO2溶液中持续通入一种气体,开始时产生沉淀随后沉淀又逐渐溶解,该气体是 2 C
金属铝及其化合物练习题
金属铝及其化合物练习题 1. 某无色透明溶液能与铝作用放出氢气, 此溶液中一定能大量共存的离子组是 A. Cl -、SO42-、Na+、K+ B. K +、ClO-、Na+、NO3- C. HCO3-、Na+、NO3-、K+ D. NO 3-、Ba2+、Cl -、NH4+ 2. 两份铝屑,第一份与过量的盐酸反应,第二份与过量的NaOH溶液反应,产生氢 气的体积比为1:2,则第一份与第二份铝屑的质量比为 A、1:1 B 、1:2 C 、1:3 D 、1:4 3. 能用铝为原料来冶炼难熔的金属主要是因为 A. 铝的密度小, 熔点较低 B. 铝在空气中燃烧, 放出大量的热 C. 铝在金属活动性顺序表排在较前面 D. 铝具有还原性. 发生氧化还原反应时放出大量的热 4. 将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 A. 稀硝酸 B. 稀盐酸 C. 硝酸铜 D. 氢氧化钠 6. 下列用途主要是体现铝的物理性质的是 ① 家用铝锅②盛浓硝酸的容器③制导线④焊接钢轨⑤包装铝箔⑥炼钢的脱氧剂 ⑦做防锈油漆⑧做合金用作飞机制造业材料⑨工业做热交换器 A. ①②③④ B. ③④⑥⑦⑧⑨ C. ①③⑤⑦⑧⑨ D. ①③②④⑥⑧ 7. 有关Al 与NaOH溶液的反应的说法中,正确的是 A. 铝是还原剂,其氧化产物是Al(OH) 3 是氧化剂,其还原产物是H2 C. 铝是还原剂,H2O和NaOH都是氧化剂 是氧化剂,Al 被氧化 8. 向某溶液中投入铝片后有大量H2 放出,则溶液中不可能大量存在的离子是 + 9. 向NaAlO2 溶液中持续通入一种气体,开始时产生沉淀随后沉淀又逐渐溶解,该气 体是 2 C
课时作业8 从铝土矿到铝合金
专题三 从矿物到基础材料 课时作业8 从铝土矿到铝合金 时间:45分钟 满分:100分 一、选择题(每小题4分,共44分) 1.把4.6 g 钠放入200 mL 0.1 mol·L -1的AlCl 3溶液中,待其充分反应后,下列叙述中错误的是( ) A .Cl -的浓度几乎不变 B .溶液呈浑浊 C .溶液中几乎不存在Al 3+ D .溶液中存在最多的离子是Na + 答案:B 2.把铝粉和Fe 3O 4粉末配成铝热剂并等分成两份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应;第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( ) A .1 ∶1 B .9 ∶8 C .3 ∶4 D .4 ∶3 解析:Al 与Fe 3O 4配成的铝热剂恰好反应时有:8Al +3Fe 3O 4=====高温4Al 2O 3+9Fe 。第一 份铝热反应的生成物为Fe 和Al 2O 3,只有Fe 与HCl 反应放出H 2,由方程式8Al ~9Fe ~9H 2,即生成9 mol H 2;第二份Al 和Fe 3O 4直接与NaOH 溶液反应,只有Al 与之反应放出H 2,由电子得失守恒8Al ~12H 2,即生成12 mol H 2。故生成的气体在相同情况下的体积之比为9 mol ∶12 mol =3 ∶4。此题易错解为1 ∶1。认为上述两反应过程中均由Al 失电子转变为 Al 3+,而误认为H +得电子相等,忽略了此过程中Fe 的价态由原来的+83 价(即+2、+3价),与盐酸反应后全部转变为+2价,即生成H 2的过程中除H +得电子外,Fe 3+也得了部分Al 所失的电子。 答案:C 3.向X 的溶液中,加入Y 试剂,产生的沉淀示意图如图所示情形的是(注意线段的斜率)( )
高中化学必修一铝及其化合物的单元练习
1.有一镁、铝合金,用适量稀硫酸恰好完全溶解,再加入氢氧化钠溶液,析出沉淀的物质的量随氢氧化钠的体积关系如图所示,则原合金中镁、铝物质的量比为 A.2∶1 B.4∶1 C.1∶1 D.1∶2 2.证明某溶液只含有Fe2+而不含有Fe3+的实验方法是 A.先滴加氯水,再滴加KSCN溶液后显红色 B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色 C.滴加NaOH溶液,先产生白色沉淀,后变为灰绿色,最后呈红褐色 D.只需滴加KSCN溶液 3.下列物品所用材料为硅酸盐的是 A.水晶镜片 B.陶瓷餐具 C.石英光导纤维 D.计算机芯片 4.下列物质组合中,既能和盐酸反应又能和烧碱溶液反应的化合物是 ①Al ②Al2O3 ③Al(OH)3 ④NaHCO3 A.①②③④ B.②③④ C.①③④ D.①②④ 5.相同物质的量的钠、镁、铝与过量的稀硫酸反应,在标况下产生氢气的体积比是A.1:1:1 B.1:2:3 C.6:3:2 D.23:24:27 6.将过量的CO2通入下列溶液中,最终不出现白色沉淀的是 A.CaCl2溶液 B.NaAlO2溶液 C.饱和Na2CO3溶液 D.水玻璃 7.A、B、C、D、E分别是 Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:(1)A、C均能与稀 H2SO4反应放出气体;(2)B与D的硝酸盐反应,置换出单质D;(3)C与强碱反应放出气体;(4)C、E在冷浓H2SO4中发生钝化反应,由此可以推断A、 B、 C、 D、E依次为 A. Fe、Cu、Al、Ag、Mg B.Al、Cu、Mg、Ag、Fe C. Mg、Cu、Al、Ag、Fe D.Mg、Ag、Al、Cu、Fe 8.向明矾[KAl(SO4)2.12H2O]溶液中加入B a(O H)2溶液,当SO42-恰好沉淀完全时,这时铝元素的存在形式是 A.A l(O H)3沉淀 B.只有AlO2-离子 C.A l(O H)3沉淀和Al3+ D.A l(O H)3沉淀和〔AlO2〕-离子 9.将过量的CO2分别通入到下列溶液中,最终溶液中有白色沉淀析出的是 ①CaCl2溶液;②Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液 A.①②③④ B.②③ C.①②③ D.②④ 10.在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 A.NH4+、NO3-、CO32-、Na+ B.Na+、Ba2+、HCO3-、AlO2- C.NO3-、K+、AlO2-、OH- D.NO3-、Mg 2+、K+、CH3COO- 11.以下转化不能通过一步反应实现的是 A.SiO2→SiF4 B.Al2O3→Al(OH)3C.Fe→FeCl2 D.SiO2→CaSiO3
相关文档
- 铝及其化合物练习题1
- 高中化学铝及其化合物性质练习题(附答案)
- 高三化学一轮复习铝及其化合物练习含答案
- 钠、铝及其化合物练习题
- 金属铝及其化合物练习题
- 铝及其化合物练习题及答案
- 铝及其化合物性质相关练习题(附答案)
- 铝及其化合物练习题及答案
- 镁铝及其化合物的性质-练习
- 《铝及其化合物》练习题
- 铝及其化合物计算题专练
- 【化学】化学 铝及其化合物推断题的专项 培优易错试卷练习题含答案
- 高三化学一轮复习铝及其化合物练习题
- 初中化学铝及其化合物练习题
- 高一化学 必修1 铝及其化合物练习题
- 铝及其化合物测试题及答案
- 铝及其化合物测试sp
- 高中化学必修一铝及其化合物检测
- 《铝及其化合物》练习题
- 铝及其化合物练习题及答案
