高中化学原子结构必修
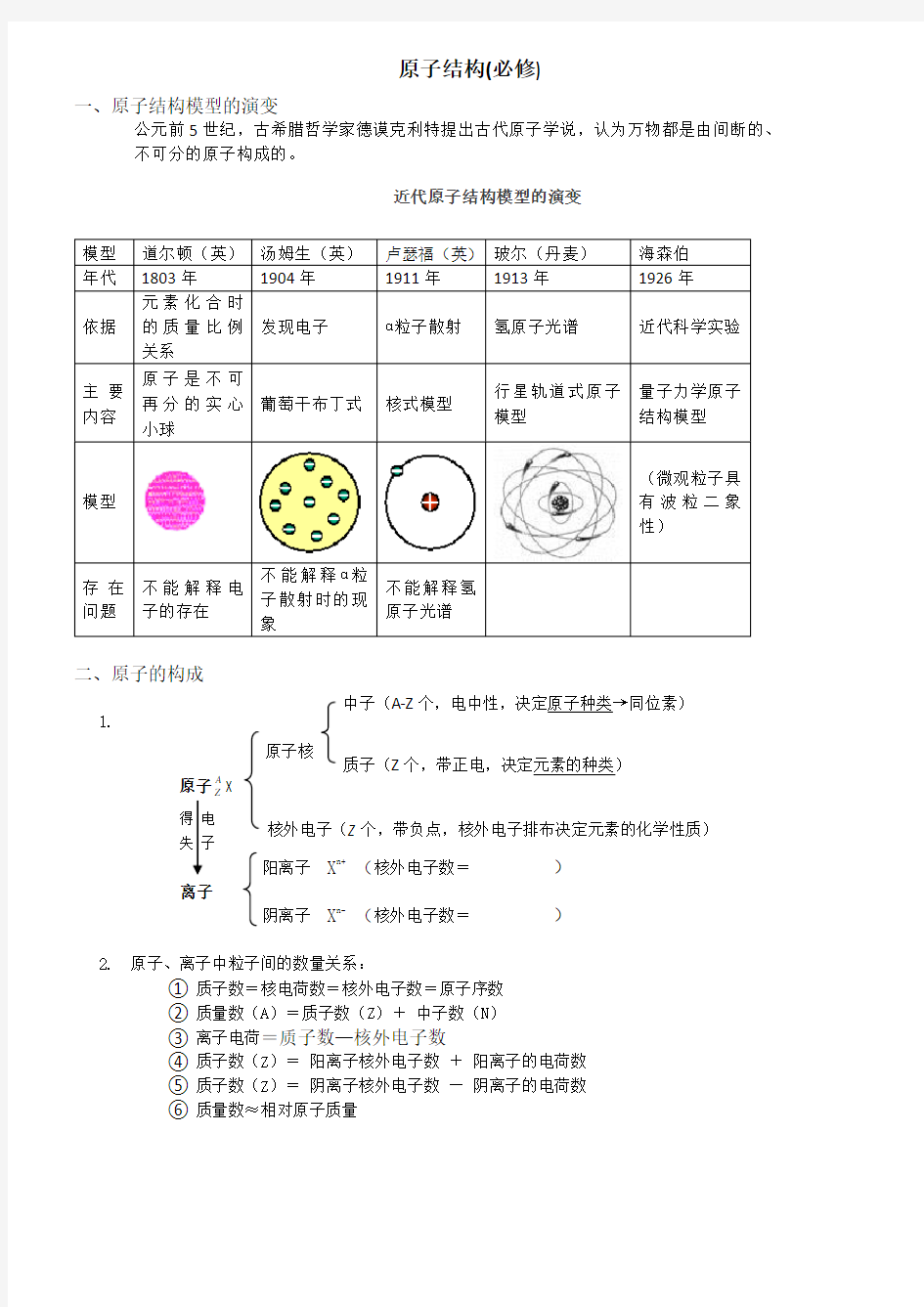

原子结构(必修)
近代原子结构模型的演变
⑤ 质子数(Z )= 阴离子核外电子数 — 阴离子的电荷数
一、原子结构模型的演变
公元前5世纪,古希腊哲学家德谟克利特提出古代原子学说,认为万物都是由间断的、 不可分的原子构成的。
模型 道尔顿(英) 汤姆生(英) 卢瑟福(英) 玻尔(丹麦) 海森伯 年代 1803年 1904年 1911年 1913年
1926年 依据 元素化合时
的质量比例关系 发现电子 ɑ粒子散射 氢原子光谱
近代科学实验
主要内容
原子是不可
再分的实心小球
葡萄干布丁式 核式模型 行星轨道式原子模型
量子力学原子结构模型
模型
(微观粒子具有波粒二象性)
存在问题 不能解释电子的存在 不能解释ɑ粒
子散射时的现
象
不能解释氢
原子光谱
二、原子的构成
1.
得 电
失 子
阳离子 X n+
(核外电子数= ) 离子
阴离子 X n- (核外电子数= )
2. 原子、离子中粒子间的数量关系:
① 质子数=核电荷数=核外电子数=原子序数 ② 质量数(A )=质子数(Z )+ 中子数(N )
③ 离子电荷=质子数—核外电子数
④ 质子数(Z )= 阳离子核外电子数 + 阳离子的电荷数 ⑥ 质量数≈相对原子质量 原子核
原子A
Z X
中子(A-Z 个,电中性,决定原子种类→同位素) 质子(Z 个,带正电,决定元素的种类) 核外电子(Z 个,带负点,核外电子排布决定元素的化学性质)
①核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的
电子层(能量最低原理);
②每个电子层最多容纳2n2个电子(n为电子层数);
③最外层电子数目不能超过8个(K层为最外层时不能超过2个);
④次外层电子数目不能超过18个(K层为次外层时不能超过2个);
⑤倒数第三层电子数目不能超过32个(K层为倒数第三层时不能超过2个)。
(2)阳离子:核电荷数=核外电子数+电荷数(如图乙所示)
(3)阴离子:核电荷数=核外电子数—电荷数(如图丙所示)
M电子层
微粒符号(原子或离子)
L电子层原子核 K电子层核电荷数
(1)原子核中无中子的原子1
1H
3.核外电子排布的一般规律
(1)
电子层数(n) 1 2 3 4 5 6 7
符号K L M N O P Q
电子层能量的关系从低到高
电子层离核远近的关系由近到远
(2)在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:
4.原子、离子的结构示意
(1)原子中:核电荷数=核外电子数(如图甲所示)
5.常见等电子粒子
(1)2电子粒子:H—、Li+、Be2+;H2、He
(2)10电子粒子:分子Ne、HF、H20、NH3、CH4 ;阳离子Na+、Mg2+、Al3+、NH4+、H30+;
阴离子N3-、O2-、F-、OH-、NH2-。
(3)18电子粒子:分子Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4;
阳离子K、Ca ;阴离子P3—、S2—、Cl—、HS—、O22—。
(4)14电子粒子:Si、N2、CO、C2H2;16电子粒子:S、O2、C2H4、HCH0 。
6.1~20号元素原子结构的特点
(2)最外层有1个电子的元素: H、Li、Na、K
(3)最外层有2个电子的元素: He、Be、Mg、Ca
(4)最外层电子数等于次外层电子数的元素:Be、Al
(5)最外层电子数是次外层电子数2倍的元素:C ;
是次外层电子数3倍的元素:O ;
是次外层电子数4倍的元素:Ne
(6)电子层数与最外层电子数相等的元素:H、Be、A1
(7)电子总数为最外层电子数2倍的元素:Be
(8)次外层电子数是最外层电子数2倍的元素:Li、Si
(9)内层电子数是最外层电子数2倍的元素:Li、P
(10)最外层电子数等于最内层电子数的元素:Be、Mg、Ca
掌握了上述一些结构特点及规律可以迅速推断元素及其原子序数等。
7.原子半径大小的比较规律
①电子层数相同时,随着原子序数递增,原子半径逐渐减少
例:r(Na)> r(Mg)> r(Al)> r(Si)> r(P)> r(S)> r(Cl)
②最外层电子数相>同时,随着电子层数的递增,原子半径逐渐增大
r(Li)< r(Na)<r(K)<r(Rb)<r(Cs)
8.离子半径大小的比较规律
①同种元素的离子半径:阴离子>原子>阳离子低价阳离子>高价阳离子
例: r(Cl—)>r(Cl) r(Fe)>r(Fe2+)>r(Fe3+)电子越多半径越大
②电子层结构相同的离子,核电荷数越大,半径越小
例: r(H—)>r(Li+) r(O2—)>r(F—)> r(Na+)> r(Mg2+)> r(Al3+) r(S2—)> r(Cl—)> r(K+)> r(Ca2+)
③带相同电荷的离子,电子层数越多,半径越大
例: r(Li+)<r(Na+)< r(K+)< r(Rb+)< r(Cs+)
r(F—)< r(Cl—)< r(Br—)< r(I—)
④带电荷数、电子层数均不同的离子可选一种离子参照比较
例:比较 r(K+)和 r(Mg2+)可选 r(Na+)作为参照:r(K+)>r(Na+)>r(Mg2+)
※注:△周期表中若元素的位置关系为 B—C 或 B—C ..则A>B>C ;若为A—B,则无法比较
A A C
△同一周期最后一种金属离子半径最小: S2—>Cl—(>F—或K+)>Na+>Mg2+>Al3+
游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。
三、元素、核素、同位素
1. 元素:具有相同核电荷数(即质子数)的同一类原子的总称。(现行元素周期表中排有112种元素)
2. 核素:具有一定数目的质子和一定数目的中子的一种原子叫核素。 (即每一种原子为一种核素,如12
13
14
C C C 、、各为一种核素)
3. 同位素:具有相同质子数而有不同种子数的同一元素的原子即同一元素的不同核素互称为同位素。
4. 同位素中各核素的特点
① 三同:同种元素(同质子数、同核电荷数、同电子数),相同位置(元素周期表中), 化学性质几乎相同。
② 三不同:不同种原子(中子数不同、质量数不同),不同的物理性质,不同丰度(原子个数百分比) ③ 两特性:同一元素的各种同位素的化学性质几乎完全相同;在天然存在的某种元素里,不论是
化学选修3第一章 原子结构与性质--教案
第一章原子结构与性质 教材分析: 一、本章教学目标 1.了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。 2.了解能量最低原理,知道基态与激发态,知道原子核外电子在一定条件下会发生跃迁产生原子光谱。 3.了解原子核外电子的运动状态,知道电子云和原子轨道。 4.认识原子结构与元素周期系的关系,了解元素周期系的应用价值。 5.能说出元素电离能、电负性的涵义,能应用元素的电离能说明元素的某些性质。 6.从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。 本章知识分析: 本章是在学生已有原子结构知识的基础上,进一步深入地研究原子的结构,从构造原理和能量最低原理介绍了原子的核外电子排布以及原子光谱等,并图文并茂地描述了电子云和原子轨道;在原子结构知识的基础上,介绍了元素周期系、元素周期表及元素周期律。总之,本章按照课程标准要求比较系统而深入地介绍了原子结构与元素的性质,为后续章节内容的学习奠定基础。尽管本章内容比较抽象,是学习难点,但作为本书的第一章,教科书从内容和形式上都比较注意激发和保持学生的学习兴趣,重视培养学生的科学素养,有利于增强学生学习化学的兴趣。 通过本章的学习,学生能够比较系统地掌握原子结构的知识,在原子水平上认识物质构成的规律,并能运用原子结构知识解释一些化学现象。 注意本章不能挖得很深,属于略微展开。 相关知识回顾(必修2) 1.原子序数:含义: (1)原子序数与构成原子的粒子间的关系: 原子序数====。(3)原子组成的表示方法 a. 原子符号:A z X A z b. 原子结构示意图: c.电子式:
人教版初三化学上册《原子的结构》精品教案
课题2 原子的结构 第1课时原子的构成相对原子质量 教学过程 情景导入 第二次世界大战的时候日本对我国进行了非常不人道的侵虐,当时穷 凶极恶的日本侵略者最后为什么会投降呢?那是因为美国给日本投了两颗 原子弹,原子弹爆炸产生的巨大杀伤力摧毁了日本最后的斗志……继而“问 题激疑”引入新课。 【问题激疑】为什么“原子弹的爆炸”会产生如此巨大的能量呢?要了解 这个问题,我们首先要弄清原子结构的奥秘。 合作探究 探究点一原子的构成 提出问题原子是化学变化中的最小粒子。在化学变化中原子不能再分,通过其他变化或方法原子还可以再分吗? 交流讨论阅读教材讨论归纳,了解原子的构成。 归纳总结 1.构成: 质子(每个质子带1个单位正电荷) 原子核 原子中子(不带电) 核外电子(每个电子带1个单位负电荷) 2.原子中核电荷数、质子数、核外电子数的关系 (1)原子不显电性,是由于原子核所带正电荷数(即核电荷数)和核外电子所带负电荷数电量相等,但电性相反,所以整个原子不显电性。 (2)在原子中,原子核所带的正电荷数(核电荷数)就是所有质子所带的电荷数(中子不带电),而每个质子带1个单位正电荷,因此,核电荷数=质子数,由于原子核内质子数与核外电子数相等,所以在原子中,核电荷数=质子数=核外电子数。 (3)根据分析教材中“几种原子的构成”的数据可知:①在原子中质子数不一定等于中子数。②并不是所有的原子都是由质子、中子和电子构成的。如氢原子。③不同种类的原子,核内的质子数不同。
探究点二 相对原子质量 提出问题 原子虽小但也有质量和体积,它的质量如何表示呢? 交流讨论 阅读教材讨论归纳,了解相对原子质量。 归纳总结 (1)定义:国际上以一种碳原子质量的1/12为标准,其他原子质量跟它相比较所得的比,作为这种原子的相对原子质量。 (2)表达式:相对原子质量=12 1*碳原子质量该原子的质量 (3)跟质子和中子相比,电子质量很小,所以原子的质量主要集中在原子核上。即相对原子质量≈质子数+中子数。 知识拓展 板书设计 第1课时 原子的构成、相对原子质量 一、原子的构成 质子(每个质子带1个单位正电荷) 原子核 原子 中子(不带电) 核外电子(每个电子带1个单位负电荷) 在原子里,核电荷数=质子数=核外电子数 二、相对原子质量 1.定义: 2.公式:某原子的相对原子质量=12 1*碳原子质量该原子的质量 3.相对原子质量=质子数+中子数
高一化学 第一节 原子结构教案
第一节原子结构 教学目标: 知识目标: 1.复习原子构成的初步知识,使学生懂得质量数和A Z X的含义,掌握构成原子的粒子间的关系。 2.了解关于原子核外电子运动特征和常识。 3.理解电子云的描述和本质。 4.了解核外电子排布的初步知识,能画出1~号元素的原子结构示意图。 能力目标: 培养自学能力、归纳总结能力、类比推理能力。 教学重点:原子核外电子的排布规律。 教学难点:原子核外电子运动的特征,原子核外电子的排布规律。 (第一课时) 教学过程: [复习]原子的概念,原子的构成,原子为什么显电中性? [板书]一、原子核 1。原子结构 质子: 1.6726×10-27kg 原子核 原子中子: 1.6748×10-27kg 电子: 1.6726×10-27kg/1836 注意:核电荷数=质子数=电子数近似原子量=质子数+中子数原子的粒子间的关系: 决定元素种类的是:,决定原子质量的 是: 决定元素化学性质的主要是:,决定原子种类的是: 1.6726×10-27kg 1.66×10-27kg 2.质量数 质子的相对质量= =1.007≈1 1.6748×10-27kg 1.66×10-27kg 中子的相对质量= =1.008≈1 将原子核内所有的质子和中子的相对质量取近似值整数加起来,所得的数值叫质量数(A) 质量数(A)=质子数(Z)+中子数(N) N = A – Z 练习:用A Z X表示原子: (1)求中性原子的中子数:N= (2)求阳离子的中子数,A X n+共有x个电子,则N=
(3)求阴离子的中子数,A X n-共有x个电子,则N= (4)求中性分子或原子团的中子数,12C16O2分子中, N= (5) A2-原子核内有x个中子,其质量数为m,则n g A2-离子所含电子的物质的量为 : . 二、核外电子运动的特征 请一位同学讲述宏观物体的运动的特征。 比较电子的运动和宏观物体的运动。 1.核外电子运动的特征: (1)带负电荷,质量很小。 (2)运动的空间范围小。 (3)高速运动。 学生阅读课本P91,播放电子云形成的动画。 2.电子云 电子在原子核外空间一定范围内出现,可以想象为一团带负电荷的云雾笼罩在原子核的周围,所以人们形象地把它叫做“电子云”。 注意:(1)图中的每个小黑点并不代表一个电子,小黑点的疏密表示电子在核外单位体积内出现机会的多少。 (2)“电子云”是核外电子运动的一种形象化表示。 1.已知一种碳原子(质子数、中子数均为6)的一个原子的质量为m kg,若一个铁原子的质量为n kg ,则铁的原子量是 2.以下有关电子云的描述,正确的是() A 电子云示意图的小黑点疏密表示电子在核外空间出现机会的多少 B 电子云示意图中的每一个小黑点表示一个电子 C 小黑点表示电子,黑点愈多核附近的电子就愈多 D 小黑点表示电子绕核作圆周运动的轨道 第二课时 [复习]1。原子的结构。 2.电子云的概念及核外电子运动的特征。 对于多电子的原子,核外电子的运动要复杂一些,通常,能量低的在离核较近的区域运动,能量高的在离核较远的区域运动。 三、原子核外电子的排布 1.电子层 层序数 1 2 3 4
高中化学原子结构必修
原子结构(必修) 近代原子结构模型的演变 ⑤ 质子数(Z )= 阴离子核外电子数 — 阴离子的电荷数 一、原子结构模型的演变 公元前5世纪,古希腊哲学家德谟克利特提出古代原子学说,认为万物都是由间断的、 不可分的原子构成的。 模型 道尔顿(英) 汤姆生(英) 卢瑟福(英) 玻尔(丹麦) 海森伯 年代 1803年 1904年 1911年 1913年 1926年 依据 元素化合时 的质量比例关系 发现电子 ɑ粒子散射 氢原子光谱 近代科学实验 主要内容 原子是不可 再分的实心小球 葡萄干布丁式 核式模型 行星轨道式原子模型 量子力学原子结构模型 模型 (微观粒子具有波粒二象性) 存在问题 不能解释电子的存在 不能解释ɑ粒 子散射时的现 象 不能解释氢 原子光谱 二、原子的构成 1. 得 电 失 子 阳离子 X n+ (核外电子数= ) 离子 阴离子 X n- (核外电子数= ) 2. 原子、离子中粒子间的数量关系: ① 质子数=核电荷数=核外电子数=原子序数 ② 质量数(A )=质子数(Z )+ 中子数(N ) ③ 离子电荷=质子数—核外电子数 ④ 质子数(Z )= 阳离子核外电子数 + 阳离子的电荷数 ⑥ 质量数≈相对原子质量 原子核 原子A Z X 中子(A-Z 个,电中性,决定原子种类→同位素) 质子(Z 个,带正电,决定元素的种类) 核外电子(Z 个,带负点,核外电子排布决定元素的化学性质)
①核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的 电子层(能量最低原理); ②每个电子层最多容纳2n2个电子(n为电子层数); ③最外层电子数目不能超过8个(K层为最外层时不能超过2个); ④次外层电子数目不能超过18个(K层为次外层时不能超过2个); ⑤倒数第三层电子数目不能超过32个(K层为倒数第三层时不能超过2个)。 (2)阳离子:核电荷数=核外电子数+电荷数(如图乙所示) (3)阴离子:核电荷数=核外电子数—电荷数(如图丙所示) M电子层 微粒符号(原子或离子) L电子层原子核 K电子层核电荷数 (1)原子核中无中子的原子1 1H 3.核外电子排布的一般规律 (1) 电子层数(n) 1 2 3 4 5 6 7 符号K L M N O P Q 电子层能量的关系从低到高 电子层离核远近的关系由近到远 (2)在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是: 4.原子、离子的结构示意 (1)原子中:核电荷数=核外电子数(如图甲所示) 5.常见等电子粒子 (1)2电子粒子:H—、Li+、Be2+;H2、He (2)10电子粒子:分子Ne、HF、H20、NH3、CH4 ;阳离子Na+、Mg2+、Al3+、NH4+、H30+; 阴离子N3-、O2-、F-、OH-、NH2-。 (3)18电子粒子:分子Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4; 阳离子K、Ca ;阴离子P3—、S2—、Cl—、HS—、O22—。 (4)14电子粒子:Si、N2、CO、C2H2;16电子粒子:S、O2、C2H4、HCH0 。 6.1~20号元素原子结构的特点
高三化学第18讲原子结构化学键教案
第18讲原子结构化学键 (第一课时) 考纲要求 1.了解元素、核素和同位素的含义。 2.了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 3.了解原子核外电子排布规律,掌握原子结构示意图、电子式、结构式的表示方法。 考点一原子结构、核素 1.原子构成 (1)构成原子的微粒及作用 原子(A Z X)原子核 Z——决定元素的种类 中子[A-Z] 在质子数确定后 决定原子种类 同位素 Z——最外层电子数决定元素的化学性质 (2)微粒之间的关系 ①原子中:质子数(Z)=核电荷数=核外电子数; ②质量数(A)=质子数(Z)+中子数(N);
③阳离子的核外电子数=质子数-阳离子所带的电荷数; ④阴离子的核外电子数=质子数+阴离子所带的电荷数。 (3)微粒符号周围数字的含义 (4)两种相对原子质量 ①原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的 1 12 的比值。一种 元素有几种同位素,就有几种不同核素的相对原子质量。 ②元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。 2.元素、核素、同位素 (1)元素、核素、同位素的概念及相互关系 (2)同位素的特征 ①同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大; ②同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。 (3)氢元素的三种核素
1 1H:名称为氕,不含中子; 21H:用字母D表示,名称为氘或重氢; 31H:用字母T表示,名称为氚或超重氢。 (4)几种重要核素的用途 核素23592U 146C 21H 31H 188O 用途核燃料用于考古断代制氢弹示踪原子 3.核外电子排布 (1)核外电子排布规律 (2)原子结构示意图 (3)核外电子排布与元素性质的关系 ①金属元素原子的最外层电子数一般小于4,较易失去电子,形成阳离子,表现出还原性,在化合物中显正化合价。 ②非金属元素原子的最外层电子数一般大于或等于4,较易得到电子,活泼非金属原子易形成阴离子,在化合物中主要显负化合价。 ③稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通
人教版九年级化学上册原子的结构教案
【学习目标】 1、知识目标:了解原子的构成。 2、学习目标:通过参与科学家对原子结构的探究实验,提高学生的实验探究能力。 【重点、难点】原子的构成 【教学过程】 [创设情景]人类在很久以前就意识到物体有大有小,而且它们总可以分解成更小的部分,那么人们到底能够将物质粉碎到多小的程度呢?这个问题一直吸引着勤于思考的人们。 [活动与探究——像科学家一样思考 [猜想]以“我想象中的原子结构”为题,请提出你的假设。 [交流讨论]学生以小组为单位交流各自的想法。 [小组汇报]学生甲:我们小组认为,原子像一个实心球体。 学生乙:原子像一个乒乓球。 学生丙:原子像一个桃子。 [点拨转入]同学心中的原子,各式各样,各不相同。随着科学技术的发展,在19世纪初,科学家们终于通过实验验证了原子的存在。英国化学家道尔顿提出了近代科学原子论:一切物质都是由最小的不能再分的粒子——原子构 成那么原子能不能再分?原子具有怎样的结构?这就是今天我们要研究的课题。我们将沿着科学家的足迹努力探索,共同打开原子世界的大门。 活动与探究——体验科学的魅力 师:请同学们根据以下科学史实,合作探究原子的结构。汤姆森是通过怎样的实验进行科学研究,才有这个伟大的发现的呢? 课件展示汤姆森的低压气体导电实验 实验探究一汤姆森低压气体导电实验 1897年英国科学家汤姆生利用某种装置使得气体中所含的某种粒子射出。特别是他发现这些粒子在正负电极板的作用下发生如下图所示的偏转。示意图如下: 请同学们根据实验讨论分析: 1、射出的这些粒子是原子吗?为什么?你认为这种微粒的带电情况如何?为什么? 2、你觉得原子能不能再分?原子中能不能只含有这种粒子?
人教版高中化学选修3第一章第一节第二课时《原子结构》教案
教案 课题:第一节原子结构(2)授课班级 课时第二课时 教学目的 知识 与 技能 1、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 2、能用电子排布式表示常见元素(1~36号)原子核外电子的排布 3、知道原子核外电子的排布遵循能量最低原理 4、知道原子的基态和激发态的涵义 5、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用 过程 与 方法 复习和沿伸、动画构造原理认识核外电子排布,亲自动手书写,体会原理情感 态度 价值观 充分认识原子构造原理,培养学生的科学素养,有利于增强学生学习化学 的兴趣。 重点电子排布式、能量最低原理、基态、激发态、光谱难点电子排布式 知识结构与板书设计三、构造原理 1.构造原理:绝大多数基态原子核外电子的排布的能级顺序都遵循下列顺序:1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s…… 2、能级交错现象(从第3电子层开始):是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。 电子先填最外层的ns,后填次外层的(n-1)d,甚至填入倒数第三层的(n-2)f的规律叫做“能级交错” 3.能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 4、对于同一电子亚层(能级)(等价轨道),当电子排布为全充满、半充满或全空时,原子是比较稳定的。 5、基态原子核外电子排布可简化为:[稀有气体元素符号]+外围电子(价电子、最外层电子) 四、基态与激发态、光谱 1、基态—处于最低能量的原子。
高中化学选修三 原子结构与性质知识总结
原子结构与性质 一 原子结构 1、原子的构成 中子N (核素) 原子核 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元素 → 元素符号 原子结构 决定原子呈电中性 电子数(Z 个) 化学性质及最高正价和族序数 体积小,运动速率高(近光速),无固定轨道 核外电子 运动特征 电子云(比喻) 小黑点的意义、小黑点密度的意义。 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 2、三个基本关系 (1)数量关系:质子数 = 核电荷数 = 核外电子数(原子中) (2)电性关系: ①原子中:质子数=核电荷数=核外电子数 ②阳离子中:质子数>核外电子数 或 质子数=核外电子数+电荷数 ③阴离子中:质子数<核外电子数 或 质子数=核外电子数-电荷数 (3)质量关系:质量数 = 质子数 + 中子数 二 原子核外电子排布规律 决定 X) (A Z
三相对原子质量 定义:以12C原子质量的1/12(约1.66×10-27kg)作为标准,其它原子的质量跟它比较所得的值。其国际单位制(SI)单位为1,符号为1(单位1一般不写) 原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。 如:一个氯原子的m(35Cl)=5.81×10-26kg。 核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。一种元素有几种同位素,就应 有几种不同的核素的相对原子质量, 相对诸量如35Cl为34.969,37Cl为36.966。 原子比较核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该质量 核素的质量数相等。如:35Cl为35,37Cl为37。 元素的相对原子质量:是按该元素各种天然同位素原子所占的原子个数百分比算出的平均值。如: Ar(Cl)=Ar(35Cl)×a% + Ar(37Cl)×b% 元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其原子个数百分比 的乘积之和。
人教版高中化学选修三《原子结构》教案设计
电子云原子轨道泡利原理洪特规则 【教学目标】 了解电子云、原子轨道、泡利原理、洪特规则 【重点难点】 电子云、原子轨道、泡利原理、洪特规则 【教学过程】 一、引言: 01.20世纪初,丹麦科学家玻尔把原子类比为太阳系,提出了原子的行星模型,认为核外电子像行星绕着太阳运行那样绕着原子核运动,玻尔还因此于1916年获得诺贝尔物理奖,然而在后来的十年里,玻尔的行星模型却被彻底否定了,你知道为什么吗? 02.那是因为电子是一种质量极小的微观粒子,电子在核外的运动速度又接近光速,因此电子的运动和光一样,具有波粒二相性。此时,不可能像描述宏观物体那样,确定一定状态的核外电子在某个时刻处于原子核外空间何处。而只能用统计的方法,确定它在原子中某一区域内出现的概率。 03.就以最简单的原子氢原子为例,这种概率统计的结果如何?有 何规律? 二、指导阅读: 01.假想给电子拍照,然后把照片叠加在一起得到电子云图像(右图)。 02.把电子出现的概率约为90%的空间圈出来,即为电子云轮廓图,该 轮廓图即为原子轨道。
03.s能级的原子轨道和p能级的原子轨道图分别如下,由此可见:s电子的原子轨道都是球形的,p电子的原子轨道是纺锤形的,每个p能级的3个原子轨道相互垂直。 三、基态原子电子排布图: 01.描述核外电子的运动状态,你已经了解了哪几个方面? 02.写出原子序数为3-10的电子排布式,到此,你能解释下列电子排布图吗? 03.阅读:泡利原理、洪特规则、电子自旋。 四、小结: 01.描述电子运动状态应从哪几方面着手? 02.构造原理解决了哪些方面的问题?其余问题靠什么解决的?
03.可见,学习原子结构的方法如何? 五、课后作业: 01.图1和图2分别表示1s电子的概率分布和原子轨道。下列说 法正确的是() A.图1中的每个小黑点表示1个电子 B.图2表示1s电子只能在球体内出现 C.图2表明1s轨道呈圆形,有无数对称轴 D.图1中的小黑点表示某一时刻,电子在核外所处的位置 02.各能级最多容纳的电子数是该能级原子轨道数的二倍,其理论依据是()A.构造原理B.泡利原理 C.洪特规则 D.能量最低原理 03.电子排布在同一能级时,总是()A.优先单独占据不同轨道,且自旋方向相同 B.优先单独占据不同轨道,且自旋方向相反 C.自由配对,优先占据同一轨道,且自旋方向相同 D.自由配对,优先占据同一轨道,且自旋方向相反 04.基态原子的4s能级中只有1个电子的元素共有()A.1种 B.2种C.3种 D.8种 05.下图中,能正确表示基态硅原子的是() A B C D
鲁教版九年级化学上册《原子的构成》教案-新版
第一节原子的构成教案 [教学目标] 知识与技能: 1、知道原子的构成、原子核外电子是分层排布以及原子质量的计算。 2、了解原子结构的表示方法,知道原子结构示意图的含义。 3、了解原子最外层电子数与元素化学性质的关系。 过程与方法: 1、通过想像、猜想—探索、证明—归纳和学生间相互讨论、交流,增强学生归纳知识、获取知识的能力。 情感态度与价值观: 1.培养学生对微观世界学习的乐趣,初步体会物质构成的奥秘,培养抽象思维能力、想象力和分析推理能力。 2.树立“结构决定性质”、“物质的微粒性”等辩证唯物主义观。 [教学重点、难点] 1、教学重点:原子的结构、离子的形成、原子质量计算。 2、教学难点:核外电子的排布。 3、[教学过程] 一、原子的构成 1.提问:(1)什么是分子、原子? 分子是保持物质化学性质的最小粒子。 原子是化学变化中的最小粒子。 (2)分子和原子的最大区别是什么? 在化学变化中,分子可以再分成原子,而原子不能再分。 2. 发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的? (1)猜想:原子不能分。 1)、原子可能是一个实心球体。 2)、原子可能像一个乒乓球。 3)、原子可能像一个樱桃。 …………
19世纪末前的科学家,如道尔顿。当时人们都认为原子不可分 其实,原子不是一个个简单的、实心的球体,而是一个空心球,几个小粒子围绕着一个大粒子运动。但这些粒子是什么呢? 其中居于原子中心的大粒子就是原子核,原子核带正电;小粒子就是电子,电子带负电,它们在原子核外的一定范围内作高速的运动。 原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。 原子的构成示意图原子结构模型图 (2)原子核还能不能再分呢? 想一想原子弹的爆炸? 原子弹爆炸正是利用原子核裂变时产生的巨大能量,这说明原子核还能再分。科学研究表明:原子核也不是简单的、不可分割的,它由质子和中子两种粒子构成。 科学研究还发现,质子带正电,中子不带电。 构成原子的粒子的电性和质量(表1)
最新整理高一化学教案原子结构教案.docx
最新整理高一化学教案原子结构教案知识目标: 1、认识原子核的结构 2、理解质量数和AZX的含义, 3、掌握质量数、质子数、中子数、电子数间的关系。能进行质量数、质子数、中子数、电子数间的简单计算 4、理解元素、核素、同位素的含义,会判断同位素 能力情感目标: 1、培养学生对数据的分析处理、概括总结能力 2、尝试运用比较、归纳等方法对信息进行加工 3、通过假说、模型等科学研究方法培养学生科学的学习方法和科学的学习态度 4、通过放射性同位素作用的自学和查阅,激发学生学习的热情 学习重点: 原子核的结构,构成原子的各微粒间的关系及同位素的判断 难点:原子核的结构及构成原子的各微粒间的关系 教法:模型展示、多媒体动画模拟、问题推进、对比归纳 学法:交流研讨、比较归纳、练习巩固 [引入]初中我们学习了原子结构的初步知识,原子由原子核和核外电子构成。那么原子核和核外电子在原子中的相对关系是怎样的呢?下面我们重温一下著名的卢瑟福实验。 [多媒体动画演示1]卢瑟福的α粒子散射实验及实验现象2· [学生活动]学生观看实验,总结现象,分析现象并思考问题:
1、大部分粒子穿过金箔不偏转,说明了什么? 2、少数粒子被偏转,个别粒子被反射分别说明了什么? 3、试想象推测原子的结构模型 [多媒体演示2]展示卢瑟福的解释:原子:原子核(带正电);核外电子(带负电)在此实验的基础上,卢瑟福提出了“核式原子模型”,较好的解释了原子核与核外电子的关系,那么,原子核内部的结构又是怎样的? 多媒体演示3学习目标1· 一、原子核核素 1、原子核的构成 [交流研讨]9·阅读P3表格,分析电子、质子、中子的基本数据表,思考讨论以下问题 微粒 电子 质子 中子 质量(Kg) 9.109×10-31 1.673×10-27 1.675×10-27 相对质量 0.000548 1.007 1.008
高中化学《原子结构与元素的性质》教案14 新人教版选修3
1.2.1 原子结构与元素的性质(第2课时) 知识与技能: 1、掌握原子半径的变化规律 2、能说出元素电离能的涵义,能应用元素的电离能说明元素的某些性质 3、进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系 4、认识主族元素电离能的变化与核外电子排布的关系 5、认识原子结构与元素周期系的关系,了解元素周期系的应用价值 教学过程: 【复习】元素周期表结构,核外电子排布式书写。 【板书】二、元素周期律 【提问】思考回答元素周期表中,同周期的主族元素从左到右,最高化合价和最低化合价、金属性和非金属性的变化有什么规律? 【回答】同周期的主族元素从左到右,最高化合价从+1~+7,最低化合价从-4~-1价,金属性逐渐减弱,非金属性逐渐增强。 【讲解】元素的性质随核电荷数递增发生周期性的递变,称为元素周期律。元素周期律的内涵丰富多样,下面,我们来讨论原子半径、电离能和电负性的周期性变化。 【板书】元素周期律:元素的性质随核电荷数递增发生周期性的递变。 1、原子半径 【讨论】原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个因素是核电荷数。这两个因素怎样影响原子半径? 【总结】电子的能层越多,电子之间的负电排斥将使原子的半径增大;而核电荷数越大,核对电子的引力也就越大,将使原子的半径缩小。这两个因素综合的结果使各种原子的半径发生周期性的递变。 【板书】影响因素:能层数、核电荷数。 【投影】主族元素的原子半径如图l—20所示。 【学与问】元素周期表中的同周期主族元素从左到右,原子半径的变化趋势如何?应如何理解这种趋势?周期表中的同主族元素从上到下,原子半径的变化趋势如何?应如何理解这种趋势? 【回答】原子半径的大小取决于两个相反的因素:一是电子的能层数,另一个是核电荷数。显然电子的能层数越大,电子间的负电排斥将使原子半径增大,所以同主族元素随着原子序数的增加,电子层数逐渐增多,原子半径逐渐增大。而当电子能层相同时,核电荷数越大,核对电子的吸引力也越大,将使原子半径缩小,所以同周期元素,从左往右,原子半径逐渐减小。 【板书】2、电离能 【讲解】气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。上述表述中的“气态”“基态”“电中性”“失去一个电子”等都是保证“最低能量”的条件。 【板书】(1)电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
高三化学考前复习教案:专题 原子结构与性质
专题二原子结构与性质(两课时) 【考试说明】 1、了解元素第一电离能、电负性等性质的周期性变化规律,了解元素电离能与原子核外电子排布的关系,能根据元素电负性说明周期表中元素金属性和非金属性的周期性变化规律。 2、认识元素周期律的本质。掌握同一周期、同一主族元素的原子结构与元素性质递变规律的关系。了解元素(主族和零族)原子结构、在周期表中的位置及其性质递变的规律。 【知识要点】 考点一:原子结构与元素周期表 1、在周期表中同一横行的元素原子所含有的相同。同一纵行相同。每一个周期总是由(ns1)开始到(ns2np6)结束.如此循环往复,可见元素周期系的形成是由于的排布发生周期性的重复。 2、随着核电荷数的递增,电子在能级里的填充顺序遵循原理,不同周期里所含元素种类不一定相同,并且随着周期序号的递增,金属元素的种类也逐渐,非金属的种类也逐渐。 3、元素的分区和族 (1)s 区:, 最后的电子填在上, 包括, 属于活泼金属, 为碱金属和碱土金属;(2)p区:, 最后的电子填在上, 包括族元素, 为非金属和少数金属;(3)d区:, 最后的电子填在上, 包括族元素, 为过渡金属; (4)ds区:, (n—1)d全充满, 最后的电子填在上, 包括, (5)f区:, 包括元素 区全是金属元素,非金属元素主要集中区。主族主要含区,副族主要含区,过渡元素主要含区。 考点二:元素周期律 1、核外电子排布的周期性变化,2、元素主要化合价的周期性变化, 3、金属性与非金属性,4、原子半径的周期性变化 1电子层数:相同条件下,电子层数越多,半径越大。 2核电荷数:相同条件下,核电荷数越多,半径越小。 3核外电子数:核电荷数相同条件下,核外电子数越多,半径越大。
高中化学《原子结构》教案2 新人教版选修3
第一章第一节原子结构(第二课时) 教学目标: 1、知道原子核外电子的排布遵循能量最低原理 2、知道原子的基态和激发态的涵义 3、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用 重点难点:能量最低原理、基态、激发态、光谱 教学过程: 〖引入〗在日常生活中,我们看到许多可见光如灯光、霓虹灯光、激光、焰火与原子结构有什么关系呢? 创设问题情景:利用录像播放或计算机演示日常生活中的一些光现象,如霓虹灯光、激光、节日燃放的五彩缤纷的焰火等。 提出问题:这些光现象是怎样产生的? 问题探究:指导学生阅读教科书,引导学生从原子中电子能量变化的角度去认识光产生的原因。 问题解决:联系原子的电子排布所遵循的构造原理,理解原子基态、激发态与电子跃迁等概念,并利用这些概念解释光谱产生的原因。 应用反馈:举例说明光谱分析的应用,如科学家们通过太阳光谱的分析发现了稀有气体氦,化学研究中利用光谱分析检测一些物质的存在与含量,还可以让学生在课后查阅光谱分析方法及应用的有关资料以扩展他们的知识面。 〖总结〗 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。 处于最低能量的原子叫做基态原子。 当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将释放能量。光(辐射)是电子释放能量的重要形式之一。 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。许多元素是通过原子光谱发现的。在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。 〖阅读分析〗分析教材p8发射光谱图和吸收光谱图,认识两种光谱的特点。 阅读p8科学史话,认识光谱的发展。 〖课堂练习〗 1、同一原子的基态和激发态相比较() A、基态时的能量比激发态时高 B、基态时比较稳定 C、基态时的能量比激发态时低 D、激发态时比较稳定 2、生活中的下列现象与原子核外电子发生跃迁有关的是() A、钢铁长期使用后生锈 B、节日里燃放的焰火 C、金属导线可以导电 D、卫生丸久置后消失 3、比较多电子原子中电子能量大小的依据是() A.元素原子的核电荷数 B.原子核外电子的多少 C.电子离原子核的远近 D.原子核外电子的大小 4、当氢原子中的电子从2p能级,向其他低能量能级跃迁时 ( ) A. 产生的光谱为吸收光谱 B. 产生的光谱为发射光谱 C. 产生的光谱线的条数可能是2 条 D. 电子的势能将升高.
人教版高三化学补习闪充方案 专题五 原子结构 元素周期律
人教版高三化学补习闪充方案 专题五原子结构元素周期律 一.高考怎么考原子结构元素周期律,根据高考指挥棒来学习原子结构元素周期律。 1.(2020年全国高考(新课标Ⅱ))一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24.下列有关叙述错误的是() A.该化合物中,W、X、Y之间均为共价键 B.Z的单质既能与水反应,也可与甲醇反应 C.Y的最高化合价氧化物的水化物为强酸 D.X的氟化物XF3中原子均为8电子稳定结构 【解析】:由上述分析可知,W为H、X为B、Y为N、Z为Na, A.H、B、N均以共价键结合,故A正确; B.Na与水、甲醇均反应生成氢气,故B正确; C.Y的最高化合价氧化物的水化物为硝酸,属于强酸,故C正确; D.XF3中B的最外层电子数为3+3=6,故D错误; 故选:D。 2.(2020年全国高考(新课标Ⅲ))W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3 与WZ相遇会产生白烟。下列叙述正确的是() A.非金属性:W>X>Y>Z B.原子半径:Z>Y>X>W C.元素X的含氧酸均为强酸 D.Y的氧化物水化物为强碱 【解析】:A.根据最高价氧化物对应水化物的酸性强弱,非金属性Cl>N>H>Na,故
A错误; B.同周期元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原子半径:Na>Cl>N>H,故B错误; C.元素X的含氧酸有硝酸和亚硝酸,亚硝酸是弱酸,故C错误; D.Y的氧化物水化物为氢氧化钠,氢氧化钠是强碱,故D正确; 故选:D。 3.(2020年天津市高考)短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是() 元素最高价氧化物的水化物X Y Z W 分子式H3ZO4 0.1mol?L﹣1溶液对应的pH(25℃) 1.0013.00 1.570.70 A.元素电负性:Z<W B.简单离子半径:W<Y C.元素第一电离能:Z<W D.简单氢化物的沸点:X<Z 【解析】:由上述分析可知,X为N、Y为Na、Z为P、W为S, A.非金属性越强、电负性越大,则元素电负性:Z<W,故A正确; B.电子层越多、离子半径越大,则简单离子半径:W>Y,故B错误; C.P的3p电子半满为稳定结构,则元素第一电离能:Z>W,故C错误; D.相对分子质量越大,物质的熔沸点越高,但由于氨气分子间含氢键,则简单氢化物的沸点:X>Z,故D错误; 故选:A。 4.(2020年1月浙江省高校招生选考)(1)比较给出H+能力的相对强弱:H2O C2H5OH(填“)”、“<”或“=”);用一个化学方程式说明OH﹣和C2H5O﹣结合H+能力的相对强弱。 (2)CaC2是离子化合物,各原子均满足8电子稳定结构。写出CaC2的电子式。 (3)在常压下,甲醇的沸点(65℃)比甲醛的沸点(﹣19℃)高。主要原因是。 【解析】:(1)水为弱电解质,能微弱的电离;而乙醇为非电解质,不能电离,故给出H+能力的相对强弱:H2O>C2H5OH;C2H5ONa能水解,即C2H5O﹣能夺取水中的氢离子,故能说明OH﹣和C2H5O﹣结合H+能力的相对强弱的化学方程式为C2H5ONa+H2O═NaOH+C2H5OH,故答案为:>;C2H5ONa+H2O═NaOH+C2H5OH;
九年级化学上册《原子的结构》教学设计
第三单元物质构成的奥秘 课题2 原子的结构 丽泽中学张涛 【教学目标】 1、知识与技能:了解原子是由质子、中子和电子构成的。初步了解相对原子质量的概念,并学会查 找相对原子质量表。 2、过程与方法:学会运用对比、归纳的方法在微观世界和宏观世界之间架起一座桥梁,充分发挥学 生的空间想象力,运用形象恰当的比喻来加深对微观世界的认识。 3、情感态度价值观:了解世界的物质性和物质的可分性,进行辩证唯物主义教育。培养学生善于想 象、敢于创新的精神。 【重点难点】 重点:原子的结构及相对原子质量, 难点:核电荷数、质子数和核外电子数的关系以及相对原子质量概念的形成。 【学情分析】本课题是学习化学的理论基础。对学生而言,研究一种看不见的粒子的构成会有很大困难。 因为学生缺乏粒子的观点,在第三单元学习水的组成时,借助水电解的微观解释图片或动画,从感性上可能会认为原子是一种实心球体。 本课题要帮助学生形成化学科学概念、知识和方法,以及观察物质的独特视角,即通过宏观物质研究其元素组成和微观结构,帮助学生更深入地认识物质的微观构成,为认同“物质是可分的” 辩证观点奠定一定的基础。 学生主要的困难是缺乏微观想象力,对原子的理解是实心球体,对原子构成粒子的种类、带电量和电性主要靠记忆,容易出现张冠李戴的情况。 【教学过程】
过20世纪整整一个世纪的努力,科学家不但打开了原子的 大门,而且发现小小的原子内部结构十分复杂。科学实验 证明在原子中心还有一个原子核。原子的结构究竟怎样 呢? 学习兴趣 【播放动画】动画部分内容为原子的中心有一个很小的球体,一些粒子围绕球体在高速旋转运动。 通过观看动画,加深对原子结构的了解。 【讲述】原子很小,一个原子跟一个乒乓球体积相比,相 当于乒乓球跟地球的体积之比。原子核比原子的体积又小 得多,若把原子比成一个庞大的体育场,而原子核只相当 于一只蚂蚁。因此,原子里有很大的空间,电子就在这个 空间里作高速运动。(原子核的体积约占原子体积的几万亿 分之一) 想象 【板书】一、原子的构成 原子核(+) 原子(电中性) 核外电子(-) 【讲解】原子核的质量几乎是整个原子的质量,原子核虽 小,但还可以再分。现代原子能的利用、原子弹的爆炸, 就是利用了原子核裂变所放出的巨大能量。那么原子核又 是怎样构成的呢??实验证明:原子核是由带正电的质子和 不带电的中子构成。其中质子数决定了原子的种类。如: 碳原子 【讲解】每个质子带一个单位正电荷,中子不带电,每个 电子带一个单位的正电荷。 【板书】 质子(+):每个质子带一个单位 正电荷 原子核 中子(不带电) 原子 核外电子:每个电子带一个单位负电荷 【讲解】每个质子带一个单位正电荷,中子不带电,原子 核所带的正电荷总数“核电荷数”等于核内质子数 【投影】表4-2 几种原子的构成【提问】1、是否所有原子中都含有中子? 2、核电荷数、质子数、核外电子数、元素 序号之间有何关系? 3、中子数与质子数一定相等吗? 4、为何原子不显电性?讨论问题,提高分析能力 【板书】原子组成中的规律:
高中化学练习-原子结构_word版含解析
课练15原子结构 基础练 1.下列有关化学用语正确的是() A.甲烷分子的球棍模型: B.NH4I的电子式: C.F原子的结构示意图: D.中子数为20的氯原子:3717Cl 2.131 53I是常规核裂变产物之一,可以通过测定大气或水中131 53I的含量变化来监测核电站是否发生放射性物质泄漏。下列有关13153I的叙述中错误的是() A. 131 53I的化学性质与127 53I相同 B. 131 53I的原子序数为53 C. 131 53I的原子核外电子数为78 D. 131 53I的原子核内中子数多于质子数 3.已知氢有3种核素(1H、2H、3H),氯有2种核素(35Cl、37Cl)。则HCl的相对分子质量可能有() A.1种B.5种 C.6种D.1 000种 4.两种微粒含有相同的质子数和电子数,这两种微粒可能是() ①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子 A.①③⑤⑥⑦⑧B.①③⑤⑦⑧ C.①③④⑤⑦D.全部都是 5.下列说法中正确的是() A.原子中,质量数一定大于质子数 B.电子层多的原子半径一定大于电子层少的原子半径 C.由两种元素组成的化合物,若含有离子键,就没有共价键 D.自然界中有多少种核素,就有多少种原子 6.镨(Pr)、钕(Nd)都属于稀土元素,在军事和国防工业上有广泛应用,下列有关说法中正确的是()
A.镨(Pr)和钕(Nd)可能互为同位素 B.140 59Pr是镨的一种新元素 C.140 59Pr核内有59个质子,核外有81个电子 D.140 59Pr质量数为140,原子序数为59,核内有81个中子 7.据报道,在火星和金星大气层中发现了一种非常特殊的能导致温室效应的气态化合物,它的结构式为16O===C===18O。下列说法正确的是() A.16O与18O为同种核素 B.16O===C===18O与16O===C===16O互为同位素 C.16O===C===18O与16O===C===16O的化学性质几乎完全相同 D.目前提出的“低碳经济”的目标是向空气中增加CO2,促进碳的平衡 8.六种粒子的结构示意图分别为 A B C D E F 请回答下列问题: (1)依次写出6种粒子的符号:_____________________________________________________________________ ___。 (2)A、B、C、D、E、F共表示________种元素、________种原子、________种阳离子、________种阴离子。 (3)上述微粒中,阴离子与阳离子可构成两种化合物,这两种化合物的化学式为________、________。 9.用A+、B-、C2-、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子)。请回答: (1)A元素是________,B元素是________,C元素是________。(用元素符号表示) (2)D是由两种元素组成的双原子分子,其分子式是________。 (3)E是所有含18个电子的微粒中氧化能力最强的单质分子,其分子式是________。 (4)F是由两种元素组成的三原子分子,其分子式是________,电子式是________。 (5)G分子中含有4个原子,其分子式是________。 (6)H分子中含有8个原子,其分子式是________。 10.已知A、B、C、D是中学化学中常见的四种不同微粒。它们之间存在如图所示的转化关系。 (1)如果A、B、C、D均是10电子的微粒,则A的结构式为________;D的电子式为________。 (2)如果A和C是18电子的微粒,B和D是10电子的微粒。
高三化学全册教案
高三化学教案(全一册)
第一章节离子、分子、原子晶体 第一节离子晶体、分子晶体 和原子晶体(一) 一、学习目标 1.使学生了解离子晶体、分子晶体和原子晶体的晶体结构模型及其性质的一般特点。 2.使学生理解离子晶体、分子晶体和原子晶体的晶体类型与性质的关系 3.使学生了解分子间作用力对物质物理性质的影响 4.常识性介绍氢键及其物质物理性质的影响。 二、重点难点 重点:离子晶体、分子晶体和原子晶体的结构模型;晶体类型与性质的关系 难点:离子晶体、分子晶体和原子晶体的结构模型;氢键 三、学习过程 (一)引入新课 [复习提问] 1.写出NaCl 、CO2、H2O 的电子式 。 2.NaCl晶体是由Na+和Cl—通过形成的晶体。 [课题板书] 第一节离子晶体、分子晶体和分子晶体(有课件) 一、离子晶体 1、概念:离子间通过离子键形成的晶体 2、空间结构 以NaCl 、CsCl为例来,以媒体为手段,攻克离子晶体空间结构这一难点 [针对性练习] [例1]如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置
(不考虑体积的大小)。 (1)请将其代表Na+的用笔涂黑圆点,以完成 NaCl晶体结构示意图。并确定晶体的晶胞,分析其构成。 (2)从晶胞中分Na+周围与它最近时且距离相等的 Na+共有多少个? [解析]下图中心圆甲涂黑为Na+,与之相隔均要涂黑 (1)分析图为8个小立方体构成,为晶体的晶胞, (2)计算在该晶胞中含有Na+的数目。在晶胞中心有1个Na+外,在棱上共有4个Na+,一个晶胞有6个面,与这6个面相接的其他晶胞还有6个面,共12个面。又因棱上每个Na+又为周围4个晶胞所共有,所以该晶胞独占的是12×1/4=3个.该晶胞共有的Na+为4个。 晶胞中含有的Cl-数:Cl-位于顶点及面心处,每.个平面上有4个顶点与1个面心,而每个顶点上的氯离于又为8个晶胞(本层4个,上层4个)所共有。该晶胞独占8×1/8=1个。一个晶胞有6个面,每面有一个面心氯离子,又为两个晶胞共有,所以该晶胞中独占的Cl-数为6×1/2=3。 不难推出,n(Na+):n(Cl-)=4:4:1:1。化学式为NaCl. (3)以中心Na+为依据,画上或找出三个平面(主个平面互相垂直)。在每个平面上的Na+都与中心 Na+最近且为等距离。 每个平面上又都有4个Na+,所以与Na+最近相邻且等距的Na+为3×4=12个。 [答案] (1)含8个小立方体的NaCl晶体示意图为一个晶胞 (2)在晶胞中Na+与Cl-个数比为1:1. (3)12个 3、离子晶体结构对其性质的影响 (1)离子晶体熔、沸点的高低取决于离子键的强弱,而离子晶体的稳定性又取决于什么?在离子晶体中,构成晶体的粒子和构成离子键的粒子是相同的,即都是阴、阳离子。离子晶体发生三态变化,破坏的是离子键。也就是离子键强弱即决定了晶体熔、沸点的
