饲料添加剂产品批准文号申请表
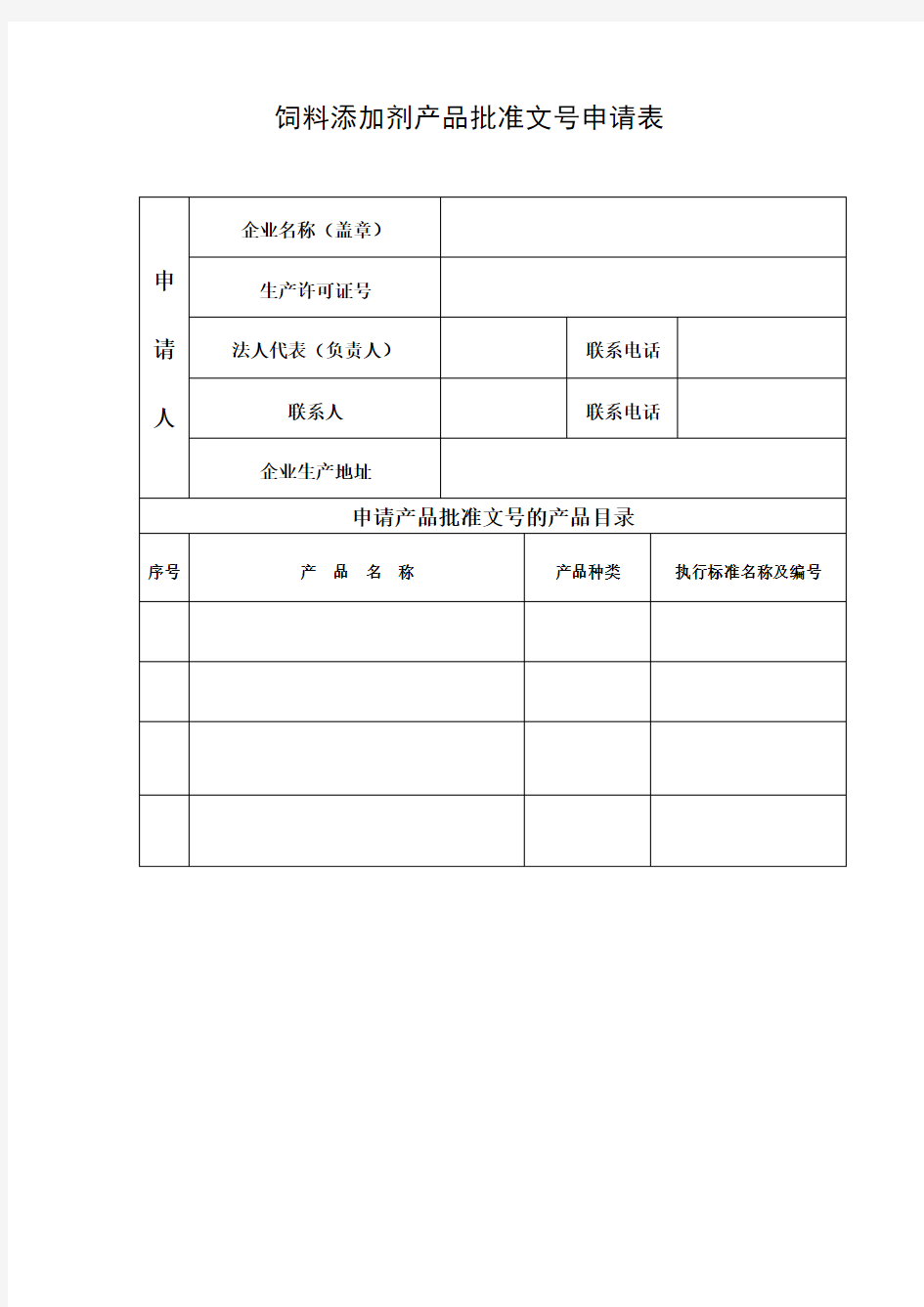
饲料添加剂产品批准文号申请表
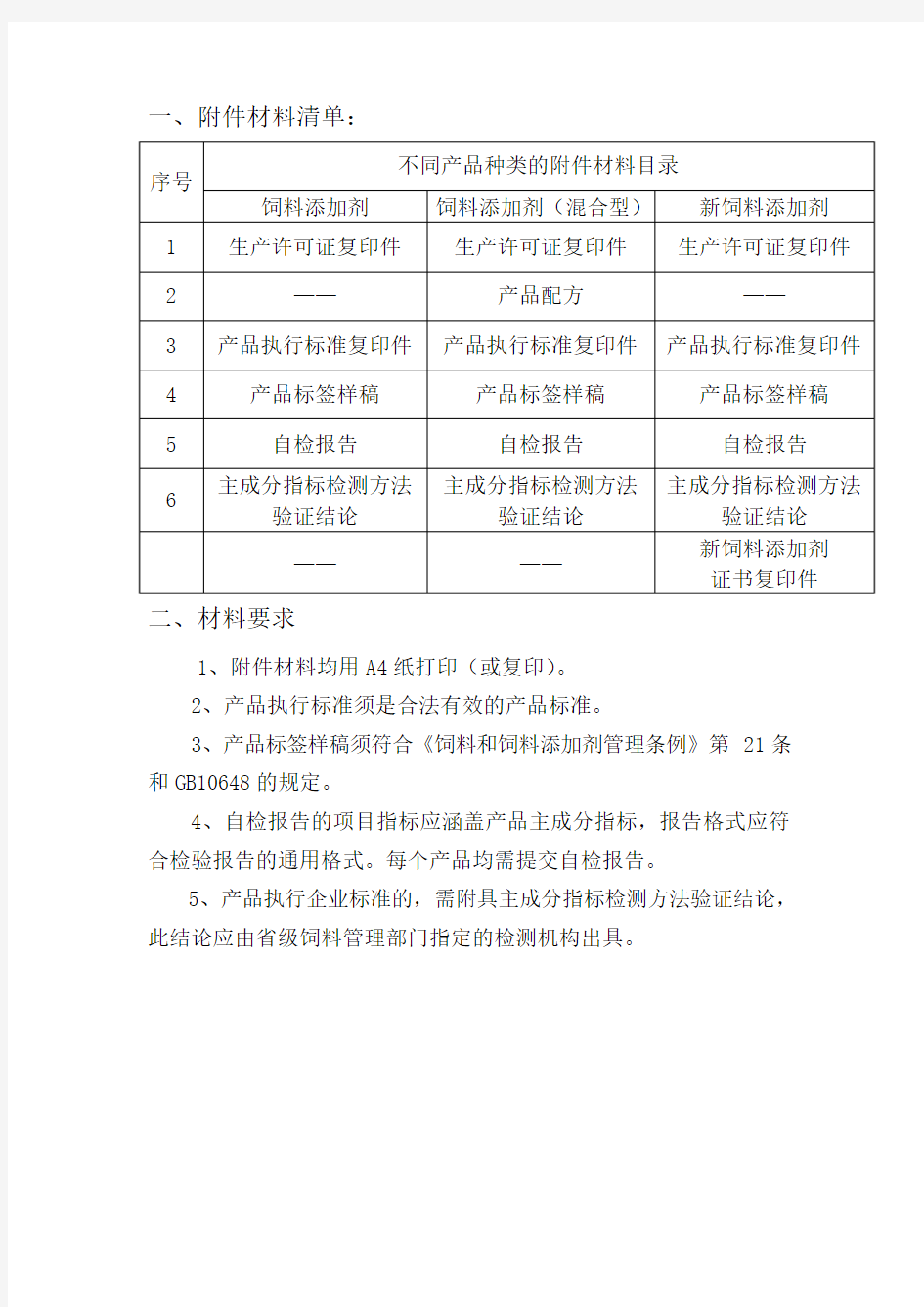
一、附件材料清单:
二、材料要求
1、附件材料均用A4纸打印(或复印)。
2、产品执行标准须是合法有效的产品标准。
3、产品标签样稿须符合《饲料和饲料添加剂管理条例》第21条和GB10648的规定。
4、自检报告的项目指标应涵盖产品主成分指标,报告格式应符合检验报告的通用格式。每个产品均需提交自检报告。
5、产品执行企业标准的,需附具主成分指标检测方法验证结论,此结论应由省级饲料管理部门指定的检测机构出具。
附表9 医疗机构注册登记申请书
附表9 医疗机构注册登记申请书 设置单位(人)(章) 组建负责人(章) 登记号 (医疗机构代码) 申请日期年月日 批准文号字()第号 山东省卫生和计划生育委员会制
填表说明 一、总体要求: 1、此表为医疗机构向登记机关申请《医疗机构执业许可证》时专用。 2、本申请表除法定代表人签字(钢笔或签字笔)、申请单位签章外,其他项目一律使用 A4规格纸张反正面打印(中文使用仿宋_GB2312小四号字,英文使用12号字),手写无效,签字需用黑色或蓝黑色墨水。 3、使用中国法定计量单位和符号。 4、规范填写,文字简练,不得涂改。 5、申请单位应当在申请表封面加盖单位公章。 二、封面填写要求: 6、设置单位(人):填写本医疗机构的上级主管单位或出资人,填写名称需与印章一致。 7、组建负责人:指设置单位(人)指定的医疗机构组建负责人。 8、登记号:即医疗机构代码,由登记注册机关统一编号填写。 9、申请日期:指注册书上交卫生计生行政部门的日期(现场手签)。 10、批准文号:填写设置医疗机构批准文号。 三、医疗机构简况填写要求: 11、医疗机构名称:指卫生计生行政部门核准的医疗机构全称。 12、所有制形式:在后面的括号中填写应选项目的号码,只能填一个。 13、隶属关系:在后面的括号中填写应选项目的号码,只能填一个,所选项目需根据设置单位确定。 14、主管单位名称:指设置单位或系统内卫生计生行政部门的名称。 15、服务对象:填写要求同12。 16、医疗机构地址:与设置批准地址一致,行政区、路、牌、号应填写完整。 17、法定代表人:医疗机构为独立法人机构,只填写其法定代表人姓名;医疗机构为非独立法人机构的,则填写具有法人地位的主管单位的法定代表人姓名及本机构主要负责人情况。 18、占地面积:按土地使用证面积填写,如无土地使用证,按实际占用数填写。 19、建筑面积:按医院总办公建筑面积填写,不包括宿舍建筑面积。 20、资金总计:固定资金加流动资金,应与月报表中的资金占用额一致。 21、固定资金:月报表中的固定资产加待处理固定资产盘亏。 22、备注:填写统一社会信用代码和其他需备注的内容。 四、诊疗科目填写要求: 23、在诊疗科目代码前的口内用划“√”方式填报。 24、医疗机构凡在某一级科目下设置二级学科(专业组)的,应填报到所列二级科目:未划分二级学科的(专业组),只填报到一级诊疗科目。在某科目下只开展门诊服务的,应在备注栏注明“门诊”字样。 25、只开展专科病诊疗的机构,应填报专科病诊疗所属的科目,并在备注栏注明专科病名称,如颈椎病专科诊疗机构填写“骨科”并于备注栏注明“颈椎病专科”。 26、诊疗科目注释: ①预防保健科:含社区保健、儿童计划免疫、健康教育等; ②全科医疗科:由医务人员向病人提供综合(不分科)诊疗服务和家庭医疗服务的均属此科目,如社区卫生服务站、基层诊所、卫生所(室)等提供的服务; ③小儿外科:医疗机构仅在外科提供部分儿童手术,未独立设立本专业的,不填报本科目;
企业信用等级评价申请书
(2012 年度) 工程名称:工程合同段: 施工单位: 建设单位 : 制表: xxxxxx 区交通运输厅 目录
一、项目概况 二、动态管理核查记录 1、人员到位(表一) 2、设备到位(表二) 3、资金到位(表三) 4、工程进度(表四) 5、三大合同履行状况(表五) 6、文明施工(表六) 7、奖惩记录(表七) 8、社会责任(表八) 填写说明 一、各项目建设单位应根据xxxxxx 交通运输厅《xxxxxx 公路工程施工企业信用评价规则实施细则》(内交发 [2011]249 号)和相关文件的精神,认真做好施工企业信用动态管理台帐记录工作; 二、施工企业信用动态管理台帐记录工作应指定专人负责,主要负责 人认真审核; 三、台帐记录内容的信用行为评定标准请按《内蒙古自治区公路工程 施工企业信用评价管理实施细则》执行; 四、台帐应按时、如实填写,原始记录不能涂改、删页,确需修改应 保留原始记录文字; 五、上年度信用评价结束后台帐记录本存档备查。
一、项目概况工程地点 技术标准 工程规模 合同金额 设计单位 监理单位质量监督单位开工时间 合同工期双向八车道高速公路交通工程。 本标段起迄桩号为: K615+536~ K672+600,全长57.064Km xxxxx区公路工程质量监督站 2012年 08月 01日 60日历天
二、动态管理核查记录 表一人员到位 合同承诺一季度二季度三季度四季度年度评价项目经理 技术负责人 安全生产负责人 项目经理 技术负责人 安全生产负责人 检查人:审核人: 项目经理 技术负责人 安全生产负责人 检查人:审核人: 项目经理 技术负责人 安全生产负责人 检查人:审核人: 项目经理 技术负责人 安全生产负责人 检查人:审核人: 投标承诺人员已按时到位,施工过程中无更换,履约情况好。计算:审核人: 注:人员有变动的,应注明是否属“不能按投标时承诺到位”或“实施过程中更换”,并附人员更换的相关审批资料。
产品目录及报价表
序号产品名称型号价格(元) 主要规格 包装目镜物镜 1单目生物显微镜XSP-105B510H5X,H10X,H16X10X,40X S+M+Z 2单目生物显微镜XSZ-104700H5X,H10X,H16X10X,40X,100X S+M+Z 3双目生物显微镜XSP-103B1650WF10X,P16X4X,10X,40X,100X S+M+Z 4单目生物显微镜XSP-103C790WF10X,P16X4X,10X,40X S+M+Z 5单目生物显微镜XSP-103C1110WF10X,P16X4X,10X,40X,100X S+M+Z 6单目生物显微镜XSZ-109A1380WF10X,P16X4X,10X,40X,100X S+M+Z 7单目生物显微镜XSZ-109B1480WF10X,P16X4X,10X,40X,100X S+M+Z 8双目生物显微镜XSZ-2091920WF10X,P16X4X,10X,40X,100X S+M+Z 9单目生物显微镜N-100A1150WF10X,P16X4X,10X,40X S+Z 10双目生物显微镜N-100B1780WF10X,P16X4X,10X,40X,100X S+Z 11单目生物显微镜N-100C1220WF10X,P16X4X,10X,40X,100X S+Z 12单目生物显微镜N-101A1450WF10X,P16X4X,10X,40X,100X S+Z 13双目生物显微镜N-101B1980WF10X,P16X4X,10X,40X,100X S+Z 14单目生物显微镜N-101C1480WF10X,P16X4X,10X,40X,100X S+Z 15单目生物显微镜XSZ-N1061820WF10X,P16X4X,10X,40X,100X S+Z 16双目生物显微镜XSZ-N1072400WF10X,P16X4X,10X,40X,100X S+Z 17双目生物显微镜XSZ-N107SP2990WF10X,P16X SP4X,10X,40X,100X S+Z 18双目生物显微镜XSZ-N107P3550WF10X,P16X P4X,10X,40X,100X S+Z 19双目生物显微镜XSZ-N2072450WF10X,P16X4X,10X,40X,100X S+Z 20三目摄影生物显微镜XSZ-N107E4690WF10X,P16X4X,10X,40X,100X S+Z 21三目摄像生物显微镜XSZ-N107CCD2750WF10X,P16X4X,10X,40X,100X S+Z 22双目生物显微镜N-200M4380WF10X,P16X CF4X,10X,40X,100X S+Z 23双目生物显微镜N-200M5280WF10X,P16X P4X,10X,40X,100X S+Z 24双目系统生物显微镜XS-21004180WF10X,P16X CF4X,10X,40X,100X S+Z 25双目系统生物显微镜XS-21004960WF10X,P16X P4X,10X,40X,100X S+Z 26三目系统生物显微镜XS-2100E4500WF10X,P16X CF4X,10X,40X,100X S+Z 备注:包装:S为塑泡,L为铝箱,Z为纸箱,M为木箱,SP为半平场物镜,P为平场物镜,CF为高反差物镜。 联系电话: , 传真:公司网址: E-mail
医疗机构执业登记注册申请书精编版
医疗机构执业登记注册 申请书精编版 MQS system office room 【MQS16H-TTMS2A-MQSS8Q8-MQSH16898】
医疗机构申请执业登记注册书设置单位(章) 组建负责人(章)登记号□□□□□□□□□□□□□□□□□(医疗机构代码) 申请日期年月日批准文号字()第号 中华人民共和国卫生部制
附表5-1-1 填表说明 1、此表为医疗机构向登记机关申请《医疗机构校验》专用。 2、医疗机构代码按照卫统发(1991)第6号文件《卫生单位名称代码及数据库管理办法(暂行)》和补充规定的有关规定填写。 3、附表5-2隶属关系:在后面的括号中填写应选项目的号码,只能填一个。 4、附表5-2所有制形式:在后面的括号中填写应选项目的号码,只能填一个。 5、附表5-2服务对象:填写要求同4。 6、附表5-2法定代表人:医疗机构拥有法人地位者:只填写其法定代表人姓名;医疗机构若无法人地位,则填写具有法人地位的主管单位的法定代表人姓名及本机构主要负责人情况。 7、附表5-3在诊疗科目代码前的口内用划“√”方式填报。 8、附表5-3医疗机构凡在某一级科目下设置二级学科(专业组)的,应填报到所列二级科目:为划分二级学科的(专业组),指天报到一级诊疗科目。在某科目下只开展门诊服务的,应在备注栏注明“门诊”字样 9、附表5-3只开展专科病诊疗的机构,应填报专科病诊疗所属的科目,并在备注栏注明专科病名称,如颈椎病专科诊疗机构填写“骨科”并于备注栏注明“颈椎病专科”。 10、附表5-4在每项空格中填写相应项目的人数。 11、附表5-4-1 职工总数:按支付工资的职工(固定工、合同工)统计。包括医院等卫生机构中的幼儿园、托儿所、药厂等附属机构的职工。不包括临时工、计划外用工,离、退休人员;也不包括独立核算、自负盈亏的服务公司的职工。“职工总数”应为“卫生技术人员数”,“其他技术人员数”和“行政后勤人员数”之和。 12、附表5-4-1人员分类:医疗机构的人员按现任职务划分(通过考核及晋升,技术职称与职务应一致,如有不一致的情况应以职务为准),不按所学的专业划分。医疗机构的负责人和主要从事管理工作的卫生技术人员计入“行政后勤人员”中。 13、附表5-4-1第一行卫生技术人员数应为“中医医生”、“中药人员”、“西药人员”、“检验人员”、“护理人员”、“放射技术人员”、“口腔技术人员”、及“其他卫技人员”之和。附表5-4-1第一行“其他技术人员”与“行政后勤人员”之和应大于等于附表5-4-2“管理人员”、“工程技术人员”、“财务人员”、及“其他人员”之和。 14、附表 5-4-1具有医疗、教学或科研多职称的卫生技术人员还应填写“研究人员”、“教学人员”中相应项目。“其他中医”指尚未评定技术职称的中医。“其他初级卫生技术人员”包括防疫员、检疫员、消毒员、牙科技术员、理疗、放射线技术员、营养员、妇幼保健员、接生员等初级卫生技术人员和中医学徒。 15. 附表 5-4-2管理人员;医疗机构的负责人和职能科室的各级管理人员按职称分类计入“管理人员”的各项中,财会人员除外。 16. 附表5-4其他人员;指原在大专院校,中专学过数学、物理、化学等非卫生专业、现从事科研、教学、医疗器械修配、卫生宣传等技术工作人员、不包括原学这些专业,现从事管理工作的人员。 17. 附表 5-4 康复治疗人员指从事运动治疗、作业治疗、言语治疗、物理因子治疗和传统康复治疗的人员。
饲料和饲料添加剂管理条例
饲料和饲料添加剂管理条例 1999年5月18日国务院第17次常务会议通过,1999年5月29日中华人民国国务院令第266号发布) 第一章总则 第一条为了加强对饲料、饲料添加剂的管理,提高饲料、饲料添加剂的质量,促进饲料工业和养殖业的发展,维护人民身体健康,制定本条例。 第二条本条例所称饲料,是指经工业化加工、制作的供动物食用的饲料,包括单一饲料、添加剂预混合饲料、浓缩饲料、配合饲料和精料补充料。 本条例所称饲料添加剂,是指在饲料加工、制作、使用过程中添加的少量或者微量物质,包括营养性饲料添加剂和一般饲料添加剂。饮料添加剂的品种目录由国务院农业行政主管部门制定并公布。 第三条国务院农业行政主管部门负责全国饲料、饲料添加剂的管理工作。 县级以上地方人民政府负责饲料、饲料添加剂管理的部门(以下简称饲料管理部门),负责本行政区域的饲料、饲料添加剂的管理工作。 第二章审定与进口管理 第四条国家鼓励研究、创制新饲料、新饲料添加剂。 新研制的饲料、饲料添加剂,在投入生产前,研制者、生产者(以下简称申请人)必须向国务院农业行政主管部门指定的机构检测和饲喂试验结果,对该新产品的安全性、有效性及其对环境的影响进行评审;评审合格的,由国务院农业行政主管部门发给新饲料、新饲料添加剂证书,并予以公布。
全国饲料评审委员会由养殖、饲料加工、动物营养、毒理、药理、代、卫生、化工合成、生物技术、质量标准和环境保护等方面的专家组成。 第五条申请人提出饲料、饲料添加剂新产品审定申请时,除应当提供新产品的样品外,还应当提供下列资料: (一)该新产品的名称、主要成分和理化性质; (二)该新产品的研制方法、生产工艺、质量标准和检测方法; (三)该新产品的饲喂效果、残留消解动态和毒理; (四)环境影响报告和污染防治措施。 第六条国务院农业行政主管部门公布的新饲料、新饲料添加剂的产品质量标准,为行业标准;需要制定国家标准的,依照标准化法的有关规定办理。 第七条首次进口饲料、饲料添加剂的,应当向国务院农业行政主管部门申请登记,并提供该饲料饲料添加剂的样品和下列资料: (一)商标、标签和推广应用情况; (二)生产国批准生产、销售的证明和生产国以外的其他国家的登记资料; (三)本条例第五条规定的资料。 前款饲料、饲料添加剂经审查确认安全、有效、不污染环境的,由国务院农业行政主管部门颁发产品登记证。 第三章生产、经营管理 第八条设立饲料、饲料添加剂生产企业,除应当符合有关法律、行政法规规定的企业设立条件外,还应当具备下列条件: (一)有与生产饲料、饲料添加剂相适应的厂房、设备、工艺及仓储设施; (二)有与生产饲料、饲料添加剂相适应的专职技术人员; (三)有必要的产品质量检验机构、检验人员和检验设施;
产品认证合同书(完整版)
合同编号:YT-FS-7974-35 产品认证合同书(完整版) Clarify Each Clause Under The Cooperation Framework, And Formulate It According To The Agreement Reached By The Parties Through Consensus, Which Is Legally Binding On The Parties. 互惠互利共同繁荣 Mutual Benefit And Common Prosperity
产品认证合同书(完整版) 备注:该合同书文本主要阐明合作框架下每个条款,并根据当事人一致协商达成协议,同时也明确各方的权利和义务,对当事人具有法律约束力而制定。文档可根据实际情况进行修改和使用。 项目编号:____ 委托方(甲方): _____ 认证方(乙方):____ 签定地点: _____ 签定日期:____年____月____日 有效期限:自签字之日起____年内有效 根据《中华人民共和国合同法》及中国认证机构国家认可委员会(cnab)和中国节能产品认证管理委员会(ccec)的有关规定,合同双方就产品认证项目协商一致,签订本合同。 一、内容和范围 1.总则 本合同适用于____产品认证的初次,扩大范围和复评认证。
对于扩大范围认证,本合同为原合同的补充,原合同仍然有效。 2.本合同为: 初次认证合同□ 扩大范围认证合同□ 复评合同□ 注:扩大范围认证指扩大产品种类,制造(加工)厂范围的认证,扩大范围认证需补充签定合同;已认证的产品种类,扩大型号规格认证时,不再另签合同。 3.甲方申请认证的产品: 制造厂名: 注册商标: 4.乙方通过审查甲方提交的产品认证申请书及相关材料;审核确认甲方的质量体系是否符合ccec/t03-XX《工厂产品质量保证能力要求》;抽样检验产品是否符合ccec/g 《认证实施规则》,以决定是否同意甲方取得或保持产品认证注册资格。 二、质量体系审核和产品抽样检验
产品认证申请书
产品认证申请书 编号: □初次认证□认证变更□认证复评 1、申请单位营业执照等法律地位文件; 2、依据DB31/T 1048《“上海品牌”评价通用要求》填写的自评报告。 (注:1.填写申请书之前,请务必认真阅读“上海品牌”认证申请须知; 2.申请书及相关资料纸质版、电子版各一份,电子版请发至邮箱: sca@https://www.sodocs.net/doc/755261683.html,,纸质版请寄至上海市普陀区武宁路509号2201室, 上海品牌国际认证联盟秘书处收。)
委托人承诺 1、同意遵守认证要求并承诺提供拟申请认证产品所需的任何信息。 2、有义务为进行认证、监督和申诉、投诉等做出必要的安排,包括审查文件、检测产品、进入认证所涉及的所有区域、调阅有关记录(包括内部审核报告)和评价所需人员(例如检验、检查、评定、监督、复评)和解决投诉的有关规定。 3、始终遵守认证计划安排的有关规定,确保认证产品质量始终符合相关的产品标准及认证规则的要求,不得将产品质量责任转移给上海品牌国际认证联盟成员认证机构或相关检测机构及人员。 4、当认证证书被暂停、撤消/注销时,应立即停止使用认证证书和标志,同时停止涉及相关认证内容的广告宣传,并按上海品牌国际认证联盟的有关规定办理该证书的暂停、撤消/注销手续。 5、有义务确保不采用误导的方式使用或部分使用认证测试报告、工厂检查报告、认证证书和认证标志。 6、在宣传本企业认证结果时,应严格按认证证书的范围做出宣传,不得损害上海品牌国际认证联盟及认证机构的声誉。 7、当获证产品的更改对产品设计或产品规范产生严重影响时,或供方所有权、组织结构、管理者发生变化,或有其它信息表明产品可能不再符合认证制度要求的情况,获证企业应通知发证机构。 8、当发生一般性顾客投诉时,要保留好有关记录;当发生重大顾客投诉和/或重大质量事故时,应及时向发证机构报告。 9、保存已知的对有关其产品与相应标准要求符合性的所有投诉记录,必须支持认证联盟及发证机构正当调阅投诉记录的义务,重要投诉应报告认证机构,同时将采取的措施施予记录; 10、对投诉、以及在产品中发现的对符合认证要求有影响的任何缺陷,应采取适当的措施,并将所采取的措施予记录。 11、遵守认证规则及程序;支付认证所需申请、试验、工厂审查及其他有关的费用;妥善保管型式试验报告、工厂检查报告和认证变更确认等认证的相关资料,以备监督检查使用;认证机构将不承担获得产品合格认证的生产商(制造商)或销售商应承担的任何法律责任。 申请单位/授权签字: 年月日(盖章)
医疗机构注册登记申请书
批准文号临兰卫医字()第号 医疗机构 注册登记申请书 设置单位(人)(章) 组建负责人(章) 登记号 (医疗机构代码) 申请日期年月日 临沂市兰山区卫生和计划生育局制
填表说明 一、总体要求: 1、此表为医疗机构向登记机关申请《医疗机构执业许可证》时专用。 2、本申请表除法定代表人签字(钢笔或签字笔)、申请单位签章外,其他项目一律使用A4规格纸张反正面打印(中文使用仿宋_GB2312小四号字,英文使用12号字),手写无效,签字需用黑色或蓝黑色墨水。 3、使用中国法定计量单位和符号。 4、规范填写,文字简练,不得涂改。 5、申请单位应当在申请表封面加盖单位公章。 二、封面填写要求: 6、设置单位(人):填写本医疗机构的上级主管单位或出资人,填写名称需与印章一致。 7、组建负责人:指设置单位(人)指定的医疗机构组建负责人。 8、登记号:即医疗机构代码,由登记注册机关统一编号填写。 9、申请日期:指注册书上交卫生计生行政部门的日期(现场手签)。 10、批准文号:填写设置医疗机构批准文号。 三、医疗机构简况填写要求: 11、医疗机构名称:指卫生计生行政部门核准的医疗机构全称。 12、所有制形式:在后面的括号中填写应选项目的号码,只能填一个。 13、隶属关系:在后面的括号中填写应选项目的号码,只能填一个,所选项目需根据设置单位确定。 14、主管单位名称:指设置单位或系统内卫生计生行政部门的名称。 15、服务对象:填写要求同12。 16、医疗机构地址:与设置批准地址一致,行政区、路、牌、号应填写完整。 17、法定代表人:医疗机构为独立法人机构,只填写其法定代表人姓名;医疗机构为非独立法人机构的,则填写具有法人地位的主管单位的法定代表人姓名及本机构主要负责人情况。 18、占地面积:按土地使用证面积填写,如无土地使用证,按实际占用数填写。 19、建筑面积:按医院总办公建筑面积填写,不包括宿舍建筑面积。 20、资金总计:固定资金加流动资金,应与月报表中的资金占用额一致。 21、固定资金:月报表中的固定资产加待处理固定资产盘亏。 22、备注:填写统一社会信用代码和其他需备注的内容。
产品认证合同协议书范本
编号号: 产品认证合同 甲方:________________________ 乙方:________________________ 签订日期:____ 年____ 月____ 日甲方(委托方):统一社会信用代码: 乙方(认证服务方): 统一社会信用代码:
根据《中华人民共和国合同法》及中国认证机构国家认可委员会(CNAB和中国节能产品认证管 理委员会(CCEC的有关规定,合同双方就产品认证项目协商一致,签订本合同。 一、内容和范围 1、总则:本合同适用于 ____________________________________________ 产品认证的初次,扩大范围和复评认证。对于扩大范围认证,本合同为原合同的补充,原合同仍然有效。 2、本合同为:()初次认证合同()扩大范围认证合同()复评合同 注:扩大范围认证指扩大产品种类,制造(加工)厂范围的认证,扩大范围认证需补充签定合同 已认证的产品种类,扩大型号规格认证时,不再另签合同。 3、甲方申请认证的产品:______________________________________________ 制造厂名: ____________________________________________ 注册商标: ____________________________________________ 4、乙方通过审查甲方提交的产品认证申请书及相关材料;审核确认甲方的质量体系是否符合CCEC/T03-2002《工厂产品质量保证能力要求》;抽样检验产品是否符合CCEC/《认证实施规则》以决定是否同意甲方取得或保持产品认证注册资格。 二、质量体系审核和产品抽样检验 1、正式质量体系审核时间拟定在 ________________________ 年 ___________________ 月份进行,最终商定的审 核时间,其偏离度不能超过一个月。(甲方如需预审核,希望审核时间 在 _________________ 年_________________ 月 _______________ 日,预审核时间至少比正式审核时间提前一个 月。) 2、甲方取得节能产品认证注册资格后,在_________________ 年有效期内,乙方对甲方自获证之日 起每12个月进行一次监督检查(包括监督审核和监督检验)。有异常情况时,酌情增加监督检 查频次。 3、用于产品认证检验用的样品由乙方派代表抽样或由质量体系审核组抽样。
饲料添加剂和添加剂预混合饲料产品批准文号管理规定
饲料添加剂和添加剂预混合饲料产品批准文号 管理规定 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】
饲料添加剂和添加剂预混合饲料产品批准文号管理办法 中华人民共和国农业部令 2012年第5号 《饲料添加剂和添加剂预混合饲料产品批准文号管理办法》已经2012年农业部第6次常务会议审议通过,现予公布,自2012年7月1日起施行。 部长:韩长赋 二〇一二年五月二日 饲料添加剂和添加剂预混合饲料产品批准文号管理办法 第一条为加强饲料添加剂和添加剂预混合饲料产品批准文号管理,根据《饲料和饲料添加剂管理条例》,制定本办法。 第二条本办法所称饲料添加剂,是指在饲料加工、制作、使用过程中添加的少量或者微量物质,包括营养性饲料添加剂和一般饲料添加剂。 本办法所称添加剂预混合饲料,是指由两种(类)或者两种(类)以上营养性饲料添加剂为主,与载体或者稀释剂按照一定比例配制的饲料,包括复合预混合饲料、微量元素预混合饲料、维生素预混合饲料。 第三条在中华人民共和国境内生产的饲料添加剂、添加剂预混合饲料产品,在生产前应当取得相应的产品批准文号。 第四条饲料添加剂、添加剂预混合饲料生产企业为其他饲料、饲料添加剂生产企业生产定制产品的,定制产品可以不办理产品批准文号。 定制产品应当附具符合《饲料和饲料添加剂管理条例》第二十一条规定的标签,并标明“定制产品”字样和定制企业的名称、地址及其生产许可证编号。 定制产品仅限于定制企业自用,生产企业和定制企业不得将定制产品提供给其他饲料、饲料添加剂生产企业、经营者和养殖者。 第五条饲料添加剂、添加剂预混合饲料生产企业应当向省级人民政府饲料管理部门(以下简称省级饲料管理部门)提出产品批准文号申请,并提交以下资料: (一)产品批准文号申请表; (二)生产许可证复印件; (三)产品配方、产品质量标准和检测方法;
泰尔认证初次产品认证时需要提交的材料及填写指南
泰尔认证初次产品认证时需要提交的材料及填写指南一、企业在申请产品认证时需要提交的材料清单
注:如申请企业没有获得GB/T19001-2008质量管理体系认证证书或证书范围不包含申请产品认证的产品时,可同时向泰尔认证中心提出质量管理体系认证申请,我中心将把GB/T19001-2008认证的现场检查和产品认证的工厂检查合并进行,做到一次审核,多张证书。 二、对申请材料准备的总要求 1、企业在准备申请材料时使用A4纸、单面打印,不要装订。 2、需要填写或签字的部分应用钢笔、签字笔。除签字部分外可以采用打印的方式。 3、所有申请材料应认真准备、一律不得涂改,应保证真实有效。 4、申请材料中凡需加盖公章的,均应提供加盖公章后的原件。 5、申请材料中需要法人签字的,应由营业执照中注明的法定代表人签字,或由法定代表人的授权人签字,但应出具法人代表授权书原件或在授权书复印件上加盖申请单位公章,被授权人才可以签字。 6、当申请单位的通信地址、联系人、联系电话及传真发生变化时应书面形式通知我中心。 三、对申请表中各项内容的填写要求(与材料代号相对应) A、申请表 1、申请表一律用钢笔或签字笔填写或采用打印方式,不得用圆珠笔、铅笔填写、不得涂改。对申请表中的每项内容(包括表中“□”处需要划“√”加以确认的内容)均应填写完整并保证真实有效。 2.申请表首页需加盖申请单位公章。申请表第二页右下角应加盖申请单位公章,第二页“法定代表人(签字)”应是申请单位营业执照上的法定代表人签字(如不是法定代表人签字的,要出具法人代表授权书原件或在授权书复印件上加盖申请单位公章,被授权人才可以签字)并加盖申请单位公章。 3、申请表中各栏目的填写要求 3.1“申请单位名称”即申请单位必须是境内的企业或境外企业驻境内的办事处。境外企业不能作为申请单位。 3.2“企业性质”:填写的企业类型对于境内企业应按法人营业执照填写,对于境外企业直接选勾“境外企业”。 3.3“产地”:应填写申请产品认证产品的最终产地并注明省市。生产单位在境外的只需填写国家或地区名称。 3.4“依据标准”:应填写生产该型号产品认证产品所采用的技术标准名称和标准编号,若采用多个标准,均需逐一列出。 3.5 “注册地址”:应按法人营业执照中的地址填写。 3.6 “商标”:应填写已经国家注册的商标,尚未取得正式注册或无商标应在此栏填“无”。 3.7“产品名称及型号/规格”:产品名称及型号/规格应符合“认证实施规则”附件1中“产品名称、单元划分”的要求。不同的认证单元应分别填写产品认证申请表。 3.8 “选择的检测分包机构”:请根据“TLC产品认证业务范围及签约检测机构一览表”中各检测分包机构的检测范围,选择并填写承担认证产品检测的机构名称。
新型饲料添加剂报告
新型饲料添加剂:低聚果糖GF13 低聚果糖GF13(Burdock oligosaccharide,BOS,分子式 GF13)是从植物中提取的天然、功能性低聚果糖,属于菊糖(Inulin)家族;其分子结构、分子量以及功能明确,是目前世界上唯一的聚合度(DP)均一、最具生物诱导活性、纯度最高(90%-99%)的低聚果糖(Fructooligosaccharides,FOS)。(到目前为止还没有证据证明DP小于8的低聚果糖具有诱导活性,而目前市场上的商品FOS 的聚合度一般在3-8)。产品本身以及生产过程无任何污染,是绿色天然的高科技生物制品。该产品技术领先,适用广泛,使用方便,物美价廉,在功能上完全可以替代壳寡糖(oligochitosan, chitooligosaccharace)。该产品拥有自主知识产权,其核心技术已申请国家发明专利。经科技查新,该研究以及生产在国内属首创,在国际上居领先水平。该项目为国家“863计划”课题项目,课题负责人陈靠山教授是山东大学生命科学学院博士生导师,原国家海洋局第一海洋研究所研究员、国家海洋局生物活性物质重点实验室主任;曾经主持了三项国家“863计划”课题项目。 果寡糖GF13是一种新型饲料添加剂,除了具有普通更低聚糖(果寡糖)的全部功能外,还具有免疫诱导活性,具有益生素的功能,可部分替代抗生素。它在动物机体营养上的作用主要表现在以下几个方面: ①作为肠道内有益寄生菌的营养基质,促进机体肠道内健康微生物菌相的形成。它在经历小肠时未被吸收,在大肠内被大多数双歧杆菌(Bifidobacterium)选择性发酵作为自身的能量和营养,有效的增殖双歧杆菌,而双歧杆菌产生的有机酸可抑制肠道内沙门氏菌等腐败菌的生长,改善肠道环境。 ②结合吸收外源性病原菌,使病原菌不致于吸附到肠壁上;而果寡糖又有不被消化道内源酶分解的特点,可携带病原菌通过肠道,防止病原菌在肠道内繁殖。 ③调节机体免疫系统,通过充当免疫刺激的辅助因子来发挥作用,提高机体对药物和抗原的免疫应答能力,从而增加动物体液免疫及细胞免疫能力,增强动物的非特异性免疫性,有效而经济地提高动物的生产性能,提高饲料利用率和产品品质。 ④抑制植酸与矿物质结合,促进矿物质的吸收利用,维持体内的矿物质平衡,提高饲料转化效率。 迄今为止在众多商品化的低聚糖中,只有果寡糖被美国FDA和日本厚生省等权威机构确认为安全有效的饲料添加剂。 果寡糖GF13作为新型饲料添加剂和饲料原料,最大的特点是高均一性、高生物活性和高纯度性,这样就决定了产品的高效性,使用户少投入多产出,见效快,特别是其具有益生素的活性,可部分替代抗生素,为饲养业和养殖业和水产养殖的可持续发展和国际化发展提供了物质保证。 [产品性状] 褐色或浅咖啡色粉末,易溶。
产品认证申请书
产品认证申请书 年月日发布年月日第二次修订年月日实施
公安部第三研究所 () 产品认证申请书认证委托人:
提交认证申请须知: .认证申请资料应按单元提交;每份认证单元申请书委托人均需加盖印章;超过一个单元时,认证委托人可按照需要汇总说明,认证委托时需提交的资料应按照相应 《产品认证实施规则》及《产品认证实施细则》中相关要求进行; . 认证委托信息填报每单元必须提交一份,相同时可复印; .认证委托人应遵守的认证规则、细则和程序;支付认证所需的申请、实验、工厂审查及其它有关的费用;妥善保管型式实验报告、工厂检查报告和认证变更确认等认证的相关资 料,以备监督检查使用; .本申请所涉及的产品符合申请认证产品的国家标准及其它相关标准或规定,认证委托人对此次声明完全负责; .选择“厂贴牌申请”项时应符合相关公开文件的要求; . 若从其他认证机构转入我机构,《认证单元申请表》中认证类别请勾选其他选项; .附表《关键元器件、部件或原材料明细表》按相应认证产品实施规则及细则附件中对于产品关键元器件、部件或原材料的要求进行填写; .附表《申请认证产品名称、型号、内外部结构照片》需按型号列全,对于网络安全产品还需提交软件版本截屏,所有图片应清晰完整,并标注出关键元器件或部 件的所在位置和电路板外型尺寸(不包含保险柜(箱)类产品); .对申请单元中内含有两个及以上型号的,须提供附表《单元内典型产品型号的功能及主要技术参数》及附表《单元覆盖产品差异对比表》; .相关表格填写不下时可另附页或调整表格大小; .获证后,请仔细核对证书信息,如有疑义,请在获证后个工作日内向受理部门提出申诉。 . 如需更进一步了解相关信息,请查阅公安部第三研究所()网站: 的公开文件目录或向我中心相关受理人员索取:简介及联络 信息、认证业务范围、认证收费标准、认证申请方和获证方的权利义务、申请 方和获证组织向申诉、投诉和争议的渠道等。 . 联系方式: 电话:-*、,传真:- 电话:-传真:- 邮箱:
最新版食品生产许可SC申请书示范文本
附件3 食品生产许可申请书 (示文本) □√食品□食品添加剂 □首次□√变更□延续 申请人名称(签字、盖章):省****食品 申请日期:2016年10 月8日
注:1.生产地址应当填写详细,设在开发区等个别楼房的,应当写明楼房编号;仅设在楼房个别楼层的,应当写明具体楼房编号和楼层号;2.外设仓库指申请人
设在生产厂区外,与生产场所位于同一县(市、区),用于贮存食品生产原辅材料和成品的场所。
局《关于公布食品生产许可分类目录的公告》(2016年第23号)中的《食品生产许可分类目录》。 2.申请食品许可,同一大类食品涉及多个类别名称或多个序号的品种明细的,每个序号的品种明细应当分栏分别填写;“品种明细”填写“其他”的,还应当在备注中填写具体产品名称。同一类别名称的多个序号的品种名细产品,加工工艺、执行标准相同的,可以合并在同一栏填写。 3.申请食品添加剂许可,类别编号为“3201”的,如涉及多个品种食品添加剂,每个品种分栏分别填写;类别编号为“3202”的,按液体、乳化、浆(膏)状、粉末(拌和、胶囊)进行归类,并分栏分别填写;类别编号为“3203”的,按配方分栏填写。 4.申请需注册、备案的产品时,备注栏需填写相应的注册批准文号或者备案登记号。
注:1.本表的填写与产品信息表对应,信息表的每一栏应当分别填写一本表。 2.本表所填工序必须覆盖审查细则、产品标准规定的各工艺要求,并按照工艺顺序填写。
注:1.本表的填写与产品信息表对应,信息表的每一栏应当分别填写一本表。 2.本表所填工序必须覆盖审查细则、产品标准规定的各工艺要求,并按照工艺顺序填写。
饲料添加剂80%标准
副本编号:广济药业(孟州)有限公司 部门: 质量监督科题目: 饲料添加剂维生素B2(核黄素)流动 性微粒 (维生素B280%喷干微粒) 共8页 第1页 文件编码: SMP-6-501新订: 01 替代:起草: 部门审查:QA审查:批准:执行日期: 2009-03-10 变更记载: 修订号:批准: 执行日期: 变更原因及目的: 文件副本分发明细 质量监督科01 检测中心02 正本:质量监督科副本编号:01-02
文本编号SMP-6-501 版本号01 生效日期2009/03/10 第 2 页共 8 页饲料添加剂维生素B2(核黄素)流动性微粒 (维生素B280%喷干微粒) 标准编号:Q/MG.C01-2009 1主题内容与适用范围 本标准规定了饲料添加剂维生素B 2(又名核黄素)流动性微粒(维生素B 2 80% 喷干微粒)产品的要求、试验方法、标签、包装、贮存及运输。 本标准适用于以生物发酵法或化学合成法生产的维生素B 2 加入适量符合 饲料卫生标准的淀粉、粘合剂及香料,经喷雾干燥而成的饲料添加剂维生素B 2流动性微粒。 2 引用标准 GB/T18632-2002 3 技术要求 3.1 性状 本品为黄色至棕黄色高流动性、无静电的均匀微粒。本品味微苦,易吸潮,溶液易变质,在碱溶液中或遇光变质更快。 3.2 饲料添加剂维生素B 2 流动性微粒应符合表1的要求。 表1 项目指标 标示量含维生素B 2 为80% 含量(以C 17H 20 N 4 O 6 计,占标示量的百分比)% 97.0~105.0 含量(以C 17H 20 N 4 O 6 计) % 77.6~84 粒度最少90%通过0.28㎜标准筛干燥失重% ≤3.0 3.3 安全卫生指标 饲料添加剂维生素B 2 流动性微粒应符合表2的安全卫生指标。 表2 项目指标 炽灼残渣/% 5 有机挥发性杂质允许量(每千克产品中)/mg 苯 2 三氯甲烷60 1,4-二氧六环380 二氯甲烷600
饲料添加剂使用的范围及分类标准
臻植生物根据目前饲料添加剂使用的范围和受限制程度,将饲料添加剂的使用分为4个标准: 1、禁止使用的添加剂 此类添加剂主要指药物饲料添加剂、兽药等。此类添加剂可通过饲料或饮水途径进入动物机体,产生药物残留,或产生“3致”性而危害人体健康,因而禁止其在食品动物中的使用。 农业部、卫生部、国家药品监督管理局联合发布公告(农业部公告176号),公布了《禁止在饲料和动物饮水中使用的药物品种目录》,该目录收载了5 类40种禁用药物品种。如肾上腺素受体激动剂,包括盐酸克伦特罗、沙丁醇胺、莱克多巴胺等,共7种; 性激素类,包括已烯雌酚、雌二醇、绒毛膜促性腺激素、促卵泡生长激素等,共12种;蛋白质同化激素,包括碘化酪蛋白、苯丙酸诺龙及其注射液2种;精神药品类,包括(盐酸)氯丙嗪、盐酸异丙嗪、安定、利血平、苯巴比妥及其钠盐等,共18种;各种抗生素滤
臻植生物渣,即各种抗生素类产品生产过程中的“3废”,对养殖业的危害较大,一是易引起耐药性,二是未做安全性检查,存在各种安全隐患。 2、可常规使用的饲料添加剂 农业部于1999年7月26日发布公告(农业部公告第105号),公布了《允许使用的饲料添加剂品种目录》,该目录共收录了允许使用的饲料添加剂12大类173种,包括饲料级氨基酸7种,饲料级维生素26种,饲料级矿物质、微量元素43种,饲料级酶制剂12种,饲料级微生物添加剂12种,饲料级非蛋白氮9种,抗氧化剂4种,防腐剂、电解质平衡剂25 种,着色剂6种,调味剂、香料6种(类),粘结剂、抗结块剂和稳定剂13种(类),其他类10种。 为加强对兽药的使用和管理,防止滥用饲料药物添加剂,根椐其使用情况,将饲料药物添加剂分为2类。具有预防动物疾病、促进动物生长作用,可在饲料中长时间添加使用的饲料药物添加剂,其产品批准文号须用“药添字”,包括二硝托胺预混剂、甲基盐霉素预混剂、黄霉素预混剂等33种;用于防治动物疾病,并规定疗程,仅是通过混饲给药的饲料药物添加剂,其产品批准文号须用“兽药字”,如环丙氨嗪预混剂、甲矾霉素散等24种。 3、无公害食品的饲料添加剂 药物饲料添加剂的使用应按照农业部发布的《饲料药物添加剂使用规范》执行。无公害生猪、肉鸡饲料中不应添加氨苯砷酸、洛克沙生等砷制
全国企业信用等级评定申请表
全国企业信用等级评定申请表
近三年财务指标与数据
附件1:《企业信息调查授权委托书》 企业信息调查授权委托书 : 本企业自愿申请你(信用服务机构)对本单位进行全国企业信用等级评审,并委托你(信用服务机构)对本企业的信用状况进行合法的信息调查与发布结果或结果公示、,企业信息调查范围包括但不限于以下信息: 企业名称、电话、邮箱、统一社会信用代码、经营状态、法定代表人、注册资本、公司类型、成立日期、营业期限、登记机关、发照日期、公司规模、所属行业、曾用名、企业地址、经营范围、股东信息、主要人员、分支机构、变更记录、被执行人、失信被执行人、裁判文书、法院公告、经营异常、股权出质、行政处罚、抽查检查、税务信息、产品信息、融资信息、动产抵押、清算信息、招聘信息、对外投资、企业年报、商标信息、专利信息、证书信息、著作权信息、软件著作权信息、网站信息等。 如需要补充提供某些材料、信息,本单位承诺积极配合提供。 以上调查信息只作为内部数据分析使用,未经许可,不可对外作盈利之用途。 授权委托单位: 法定代表人: 授权委托日期:
附件2:《信用承诺书》 信用承诺书 为促进企业信用体系建设,营造良好信用环境,树立信用意识,加强企业自律,本企业自愿做出以下承诺: 一、遵守国家法律、法规和规章,依法开展生产经营活动。 二、加强财务管理,依法及时纳税,不偷税不漏税。 三、加强质量管理,保证产品和服务质量,不制假售假,不虚假宣传,维护消费者的合法权益。 四、加强合同管理,严格履行合同,不违约毁约,不恶意逃债,依法解决合同纠纷。 五、加强安全生产管理,建立健全安全生产管理制度,杜绝事故发生。 六、树立环保意识,遵守环保法规,污染物达标排放。 七、按时支付员工工资,缴纳社保,保障员工合法权益。 八、及时合规披露企业信息。 九、接受政府、行业组织、社会公众、新闻舆论监督。 十、本企业法定代表人已认真阅读了上述承诺,并向本企业员工作了宣传教育,保证履行承诺,如有违反,自愿接受政府相关机构的联合惩戒。 承诺单位名称: 法定代表人签字: 年月日
医疗机构设置审批与执业登记申请书
医疗机构设置审批及执业登记申请书 1.申请办理表格 表单一设置医疗机构申请书 设置医疗机构申请书 设置单位(人):(章)
年月日表单二医疗机构申请执业登记注册书 附表5 医疗机构申请执业登记注册书 设置单位(盖章) 组建负责人签字 登记号 □□□□□□□□□□□□□□□□□□(医疗机构代码) 申请日期年月日 批准文号字()第号 中华人民共和国卫生部制
附表5-1 填表说明 1、此表为医疗机构向登记机关申请《医疗机构执业许可证》时专用。 2、医疗机构代码按照卫统发(1991)第6号文件《卫生单位名称代码及数据库管理办法(暂行)》和补充规定的有关规定填写。 3、附表5-2隶属关系在后面的括号中填写应选项目的号码,只能填一个。 4、附表5-2所有制形式在后面的括号中填写应选项目的号码,只能填一个 5、附表5-2服务对象填写要求同4 6、际表5-2法定代表人医疗机构拥有法人地位者,填写其法人代表姓名;医疗机构若无法人地位,则填写具有法人地位的主管单位的法人代表姓名。 7、附表5-3在诊疗科目代码前的□内用划“√”方式填报。 8、附表5-3医疗机构如在某项一级科目下未划分二级学科(专业组)的,只填报一级科目。如划分并开展二级科目诊疗活动,应填报二级科目。 9、附表5-3开展专科疾病诊疗的机构,如其它诊疗科目未能涵盖该专科疾病的,应填报专科疾病所属的科目,并在备注栏注明专科疾病名称。如填报“骨科”并于备注栏注明“颈椎病”。 10、附表5-4在每项空格中填写相应项目的人数。 11、附表5-4管理人员指医疗机构的领导人和职能科室的各级管理人员,财会人员除外。 12、附表5-4康复治疗人员指从事运动治疗、作业治疗、言语治疗、物理因子治疗和传统康复治疗的人员。 13、附表5-5普通设备按医疗机构基本标准中的医疗设备标准逐项填写。 14、填表5-6凡是在94年9月1日以前开业的医疗机构要填写此项,在94年9月1日以后申请新开业的医疗机构可不填写。 15、附表5-6出院者平均住院日计算公式: 出院者占用总床日数 出院人数 16、附表5-6平均每一门诊诊疗人次医疗费(元)计算公式: 上一年全年门诊医疗费用总数(元) 上一年全年门诊诊疗人次总数 门诊医疗费用包括:挂号费、药费、检查治疗费等门诊收入。 17、附表5-6平均每一出院者住院医疗费(元)计算公式: 上一年全年出院者住院医疗费用总数(元) 上一年全年出院总人数 住院医疗费用包括:住院费、药费、手术费、检查治疗费等住院收入。 18、附表5-6出院者平均每天住院医疗费(元)计算公式: 平均每一出院者住院医疗费(元) 出院者平均住院日
相关文档
- 新型饲料添加剂..
- 进口饲料和饲料添加剂产品登记证目录(2012-13)
- 饲料和饲料添加剂管理条例
- 饲料添加剂使用的范围及分类标准
- 饲料添加剂
- 饲料添加剂和添加剂预混合饲料产品批准文号管理规定
- 饲料添加剂品种
- 饲料添加剂生产许可
- 常见饲料添加剂种类和应用效果(讲稿)
- 饲料添加剂80%标准
- 新饲料添加剂申报材料怎么写
- 允许进口饲料和饲料添加剂的国家与地区及产品名单
- 允许进口饲料和饲料添加剂国家(地区)产品名单(更新至2017年5月19日)
- 新饲料和新饲料添加剂申报材料要求
- 饲料添加剂.ppt
- 新型饲料添加剂
- 五大生物饲料添加剂
- 饲料和饲料添加剂新产品目录 03
- 进口饲料和饲料添加剂产品登记证目录(2015-06)
- 进口饲料和饲料添加剂产品登记证目录(2014-01)
