过氧化氢含量的测定

植物组织过氧化氢含量的测定
植物组织过氧化氢含量 的测定 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】
配制100ml 、100umol/L 的过氧化氢溶液需要多少30%的过氧化氢原液请写出计算过程。答:首先计算其摩尔浓度: 若30%为其质量百分数 双氧水30%浓度的试剂(上海国药集团出品),室温时实测密度为:1,122g/L,所以,1L 30%含量的双氧水中过氧化氢含量为:1122g/L ×1L×30%=337g 又H2O2的分子量为,那么1L 30%含量的双氧水中过氧化氢浓度为:337/= mol/L. 100ml×10-3×100umol/L×10-6=mol/L×V V=10-6L=1 ul 若30%为体积分数 100% H2O2密度是1,440 g/L, 30 ml H2O2的质量为1440 g/L ×30 ml×10-3=,30%含量的双氧水中过氧化氢浓度为:= mol/L. 100ml×10-3×100umol/L×10-6=mol/L×V V=×10-7L= ul 植物组织中过氧化氢含量测定 植物在逆境下或衰老时,由于体内活性氧代谢加强而使H2O2发生累积。H2O2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。过氧化氢酶可以清除H2O2,是植物体内重要的酶促防御系统之一。因此,植物组织中H2O2含量和过氧化氢酶活性与植物的抗逆性密切相关。本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。 【原理】 H2O2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被H2SO4溶解后,在415nm波长下比色测定。在一定范围内,其颜色深浅与H2O2浓度呈线性关系。
过氧化氢酶活力的测定实验报告
竭诚为您提供优质文档/双击可除过氧化氢酶活力的测定实验报告 篇一:实验35过氧化氢酶的活性测定 植物在逆境下或衰老时,由于体内活性氧代谢加强而使h2o2发生累积。h2o2可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体。过氧化氢酶可以清除h2o2,是植物体内重要的酶促防御系统之一。因此,植物组织中h2o2含量和过氧化氢酶活性与植物的抗逆性密切相关。本实验用分光光度法测定过氧化氢含量,利用高锰酸钾滴定法和紫外吸收法测定过氧化氢酶活性。 一、过氧化氢含量的测定 【原理】 h2o2与硫酸钛(或氯化钛)生成过氧化物—钛复合物黄色沉淀,可被h2so4溶解后,在415nm波长下比色测定。在一定范围内,其颜色深浅与h2o2浓度呈线性关系。 【仪器和用具】 研钵;移液管0.2ml×2支,5ml×1支;容量瓶10ml×
7个,离心管5ml×8支;离心机;分光光度计。 【试剂】 100μmol/Lh2o2丙酮试剂:取30%分析纯h2o257μl,溶于100ml,再稀释100倍;2mol/L硫酸;5%(w/V)硫酸钛;丙酮;浓氨水。【方法】 1.制作标准曲线:取10ml离心管7支,顺序编号,并按表40-1加入试剂。 待沉淀完全溶解后,将其小心转入10ml容量瓶中,并用蒸馏水少量多次冲洗离心管,将洗涤液合并后定容至10ml 刻度,415nm波长下比色。 2.样品提取和测定:(1)称取新鲜植物组织2~5g(视h2o2含量多少而定),按材料与提取剂1∶1的比例加入4℃下预冷的丙酮和少许石英砂研磨成匀浆后,转入离心管 3000r/min下离心10min,弃去残渣,上清液即为样品提取液。(2)用移液管吸取样品提取液1ml,按表35-1加入5%硫酸钛和浓氨水,待沉淀形成后3000rpm/min离心10min,弃去上清液。沉淀用丙酮反复洗涤3~5次,直到去除植物色素。(3)向洗涤后的沉淀中加入2mol硫酸5ml,待完全溶解后,与标准曲线同样的方法定容并比色。3.结果计算:植物组织中h2o2含量(μmol/gFw)= 式中c—标准曲线上查得样品中h2o2浓度(μmol);Vt —样品提取液总体积(ml);V1—测定时用样品提取液体积
(完整word版)过氧化氢的测定
Fenton体系下过氧化氢的测定 一、反应体系中双氧水测定方法的建立 体系中双氧水的测定主要采用高锰酸钾法和碘量法,碘量法检出限较高、操作繁琐,高锰酸钾法是较常规的分析方法,操作简单且准确性高,但在Fenton氧化体系中,由于可被高锰酸钾氧化的亚铁离子和有机物的存在,测定结果往往偏高。因此,本实验采用了已有报道的钛盐光度法测定Fenton体系氧化过程中的过氧化氢含量。 钛盐光度法测定过氧化氢的原理是过氧化氢与钛离子在酸性溶液中形成稳定橙色络合物—过钛酸(pertitanic acid),此络合物颜色的深浅与样品中过氧化氢的含量成正比。姜成春等在蒸馏水体系、含有机物体系及Fenton高级氧化体系中,对高锰酸钾法、碘量法和钛盐光度法测定过氧化氢的结果进行对比分析,得出可见钛盐光度法测定过氧化氢具有较高的灵敏度,而且检测限较低,有利于低浓度过氧化氢的测定,避免了氧化还原法测定低浓度过氧化氢通过终点颜色判断所带来的误差。 二、钛盐光度法测定过氧化氢方法的建立: 仪器及实验药品: 1、DR2800;哈希管; 2、药品:100mg/l过氧化氢;3mol/l硫酸溶液;0.05mol/l 草酸钛钾溶液; 三、测定波长为400nm 四、标准曲线的测定:
分别取已配置好的双氧水标准溶液(100mg/L)已用高锰酸钾法标定,取0.2,0.4,0.6,0.8,1.0,1.2ml于哈希管中,分别加入0.5ml 的3.0mol/l硫酸溶液和0.05mol/l草酸钛钾溶液,再加入适量纯水至5ml。放置10min,在400nm波长下,以试剂空白作参比,测定其吸光度。 Fenton氧化体系中双氧水的测定:将反应结束后的一定量的待测溶液加入哈希管中,分别加入0.5ml的3.0mol/L硫酸溶液和0.05mol /L草酸钛钾溶液,定量至5ml并摇匀后放置10min,在400nm波长下,以试剂空白作参比,测定其吸光度。根据所测吸光度于标准曲线上查的双氧水的含量。 五、条件的确定 在做标线之前分别考虑了硫酸和草酸钛钾用量的影响,通过做的结果发现,在过氧化氢量一定的条件下,3mol/l硫酸和0.05mol/l草酸钛钾用量都在0.5ml时测定吸光度最大,用量低于0.5ml和高于0.5ml,其吸光度都相对降低,在0.5ml时,其吸光度是最大的。所以对于本实验硫酸和草酸钛钾用量都是0.5ml。 六、过氧化氢100mg/l的标线如下: 过氧化氢浓度(mg/l) 4 8 12 16 20 24 吸光度0.154 0.31 0.456 0.61 0.776 0.927
过氧化氢含量的测定
过氧化氢含量的测定 随着新版GMD的实施和推广,对无菌药品的生产也提高了相应的要求,而灭菌一直以来都是无菌产品的关键环节,为了提高产品的质量,选择合适的灭菌方式就显得尤为重要。 在各种灭菌技术当中,气态过氧化氢(H?O?)灭菌技术被公认为理想的灭菌方式。过氧化氢蒸气(VHP)消毒技术正迅速成为制药、生物技术和医疗卫生行业生物净化方法的选择,对与高压锅相同的生物指示剂-嗜热脂肪芽抱杆菌达到6-log的杀灭率。这种灭菌方式目前已广泛应用于制药、生物科技生物医学、卫生保健、生物、食品和环境保护等诸多方面。 双氧水消毒剂 双氧水消毒液是一种临床常用的消毒剂,对大多数细菌繁殖体有较好的杀灭效果。双氧水消毒液为无色透明液体, 有效成分为过氧化氢,工业品的有效含量在40%左右,一般用水稀释使用。有研究表面,用浓度为32.3%双氧水消毒液原液作用1min,对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌杀灭率为99.99%;作用30min 对白色念珠菌的杀灭率为99.41% ;作用90min对枯草杆菌黑色变种芽孢杀灭率为99.92% 以上。 实验方法 掌握以Na?C?O?,为基准物质标定KMnO?,标准溶液的原理和方法
掌握用高锰酸钾法测定过氧化氢含量的原理和方法 实验原理 H?O?于其氧化还原性,广泛应用于漂白、消毒、杀菌医药等工业,因此常需要测定它的含量。 H?O?分子中含有一个过氧键-O-O-,既可在一定条件下作为氧化剂,又可在一定条件下作为还原剂。在稀硫酸介质中,在室温条件下KMnO?可将其定量氧化,因此可用高锰酸钾法测定过氧化氢含量,其反应式为: 滴定在酸性溶液中进行,反应时锰的氧化数由+7变到+2。开始时反应速度慢,滴入的KMnO?溶液褪色缓慢,待有Mn2?生成后,由于Mn2?的催化作用,反应速度加快,故能顺利滴定,当滴定至溶液中有稍过量的滴定剂MnO?—(2*10-6 mol/L)时,溶液呈现微红色,显示终点。根据KMnO?溶液的浓度和滴定消耗的体积,即可计算H?O?的含量。 试剂及仪器
过氧化氢含量的测定实验报告
实验一过氧化氢含量的测定(高锰酸钾法) 一、实验目的 (1)掌握高锰酸钾法测定过氧化氢含量的原理、滴定条件和操作步骤; (2)掌握移液管及容量瓶的正确使用方法,熟悉液体样品的取样和稀释操作。 二、实验原理 (1)由于在酸性溶液中,KMnO 4的氧化性比H 2 O 2 的氧化性强,所以,测定H 2 O 2 的 含量时,常采用在稀硫酸溶液中,室温条件下用高锰酸钾法测定。其反应为: 5H 2O 2 +2MnO 4 -+6H+=2Mn2++8H 2 O+5O 2 % 100 01701 .0 % 2 2 ? ? ? = M V C O H 实验室用Na 2C 2 O 4 标定KMnO 4 溶液, KMnO4溶液在热得酸性溶液中进行,反应如下: 2KMnO 4?+5H 2 C 2 O 4 +6H+=2Mn2++10CO 2 +8H2O C(KMnO 4)=2m(Na 2 C 2 O 4 )/5M(KMnO 4 )V(KMnO 4 ) 开始反应缓慢,第1滴溶液滴入后不易褪色,待产生Mn2+后,由于Mn2+的催化作用,加快了反应速率,故滴定速度也应加快,直至溶液呈微红色且半分钟内不退色,即为终点。根据高锰酸钾浓度和滴定中消耗KMnO 4 的体积,按下式计算过氧化氢的含量: 式中p(H 2O 2 )——稀释后的H 2 O 2 质量浓度,g/L。 三、仪器与试剂 仪器:移液管(25ml),吸量管(10ml),洗耳球,容量瓶(250ml),酸式滴定管(50ml). 试剂:工业H 2O 2 样品,KMnO 4 L)标准溶液,H 2 SO 4 (3mol/L)溶液。 四、实验步骤 的KMnO 4 标准溶液的配置及标定 (1)LKMnO 4 标准溶液的配制 ~固体,置于500ml烧杯中,加入400ml蒸馏水→表面皿,煮沸20~30min→→冷却后倒入棕色瓶,加水稀释至500ml,摇匀,静置7~10d→→→上清液砂芯漏斗过滤→洗净试剂瓶,滤液倒进试剂瓶,贴上标签,待标定 KMnO 4 标准溶液的标定 (2)准确称取~基准物Na 2C 2 O 4, 置于250ml锥形瓶中→→→→ 40ml蒸馏水,15ml H 2SO 4 (3mol/L),水浴至蒸汽冒出→ 趁热标定,开始速度慢点,随后可适当加快但不能使溶液连续流下,紫红色快褪 去时速度再次减慢→→ 最后加半滴KMnO 4 标准溶液,在摇匀后30s内保持红色不退去,表明到达终点。记 下KMnO 4 标准溶液的体积。 平行滴定三次 2.H 2O 2 的含量测定 用吸量管吸取10mlH 2O 2 样品(约为3%),置于250ml容量瓶中,加水稀释至标 线,混合物均匀。用移液管准确移取过氧化氢稀释液三份,分别置于三个250ml 锥形瓶中,各加5mlH 2SO 4 (3mol/L),用高锰酸钾标准溶液滴定。开始反应缓慢, 待第一滴高锰酸钾溶液完全褪色后,再加入第二滴,随着反应速度的加快,可逐渐增加滴定速度,直到溶液呈为微红色且半分钟内不退色,即为终点。计算未经稀释样品中的含量。
分析化学实验过氧化氢含量的测定实验报告
姓名:班级:同组人: 项目过氧化氢含量的测定课程:分析化学学号: 一、实验目的 1. 了解高锰酸钾标准溶液的配制方法和保存条件。 2. 掌握以N単C2O4为基准物标定高锰酸钾溶液浓度的方法原理及滴定条 件。 3. 掌握用高锰酸钾法测定过氧化氢含量的原理和方法。 二、实验原理 标定高锰酸钾溶液的基准物质有H2C2O4 ? 2H2O、Na2C2O4、FeSC4 ? 7H2O、(NH4)2SO4?6H2O、AS2O3和纯铁丝等。由于前两者较易纯化,所以在标定高锰酸钾时经常采用。 本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L的高锰酸钾溶液,两者反应方程式如下:2KMn O4+5Na2C2O4+8H2SO4===2 Mn SO4+8H2O+10CO2 T +5Na2SO4+K2SO4 H2O2是一种常用的消毒剂,在医药上使用较为广泛。在酸性条件下,可用KMnO4标准溶液直接测定H2O2,其反应如下:2MnO4一+5H2O2+6H+= 2Mn2 ++5O2+8H2O 此反应可在室温下进行。开始时反应速度较慢,随着Mn 2+的产生反应速度会逐渐加快。因为H2O2不稳定,反应不能加热,滴定时的速度仍不能太快。测定时,移取一定体积H2O2的稀释液,用KMnO 4标准溶液滴定至终点,根据KMnO 4溶液的浓度和所消耗的体积,计算H2O2的含量。 注:1?用KMnO4溶液滴定H2O2时,不能用HNO3或HCI来控制溶液酸度。 2. H2O2样品若系工业产品,常加入少量乙酰苯胺等稳定剂,这时会造成误差,可改用碘量法测定。 三、仪器和药品 仪器:电子天平、称量瓶、50mL酸式滴定管、10、25、50mL移液管、 50mL量筒、电炉、2mL刻度吸管、250mL容量瓶 试剂:3mol L-1H2SO4、0.02mol L--1KMnO4标准溶液、Na2C2O4、 过氧化氢样品(质量分数约为30%) 四、内容及步骤 1、0.02mo L-1KMnO4溶液的配制 用台秤称取约1.7gKMnO4溶于500mL水中,盖上表面皿,加热煮沸1h,煮时及时补充水。静置一周后,用玻璃砂芯漏斗过滤,保存于棕色瓶中待标 2、K MnO4溶液浓度的标定
双氧水中过氧化氢的测定
实验十四过氧化氢含量的测定—高锰酸钾法 【目的要求】 1.掌握高锰酸钾标准溶液的配制和标定方法。 2.学习高锰酸钾法测定过氧化氢含量的方法。 【实验原理】 H2O2是医药、卫生行业上广泛使用的消毒剂,它在酸性溶液中能被KMnO4定量氧化而生成氧气和水,其反应如下: 5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2 滴定在酸性溶液中进行,反应时锰的氧化数由+7变到+2。开始时反应速度慢,滴入的KMnO4溶液褪色缓慢,待Mn2+生成后,由于Mn2+的催化作用加快了反应速度。 生物化学中,也常利用此法间接测定过氧化氢酶的活性。在血液中加入一定量的H2O2,由于过氧化氢酶能使过氧化氢分解,作用完后,在酸性条件下用标准KMnO4溶液滴定剩余的H2O2,就可以了解酶的活性。 【仪器试剂】 台秤(0.1g)、天平(0.1mg),试剂瓶(棕色),酸式滴定管(棕色,50cm3),锥形瓶(250cm3),移液管(10cm3、25cm3);H2SO4(3 mol·dm-3),KMnO4(s),Na2C2O4(s,AR.),双氧水样品(工业)。 【实验步骤】 1. KMnO4溶液(0.02 mol·dm-3)的配制 称取1.7g 左右的KMnO4放入烧杯中,加水500cm3,使其溶解后,转入棕色试剂瓶中。放置7-10天后,用玻璃砂芯漏斗过滤。残渣和沉淀则倒掉。把试剂瓶洗净,将滤液倒回瓶内,待标定。 2. KMnO4溶液的标定 精确称取0.15~0.20g预先干燥过的Na2C2O4三份,分别置于250cm3锥形瓶中,各加入40cm3蒸馏水和10cm33 mol·dm-3H2SO4,水浴上加热直约75-85℃。趁热用待标定的KMnO4溶液进行滴定,开始时,滴定速度宜慢,在第一滴KMnO4溶液滴入后,不断摇动溶液,当紫红色退去后再滴入第二滴。溶液中有Mn2+产生后,滴定速度可适当加快,近终点时,紫红色褪去很慢,应减慢滴定速度,同时充分摇动溶液。当溶液呈现微红色并在半分钟不褪色,即为终点。计算KMnO4溶液的浓度。滴定过程要保持温度不低于60℃。 3. H2O2含量的测定: 用移液管吸取5.00cm3双氧水样品(H2O2含量约5%),置于250cm3容量瓶中,加水稀释至标线,混合均匀。
分析化学实验 过氧化氢含量的测定 实验报告
实验报告 姓名:班级:同组人: 项目过氧化氢含量的测定课程:分析化学学号: 一、实验目的 1.了解高锰酸钾标准溶液的配制方法和保存条件。 2.掌握以Na2C2O4为基准物标定高锰酸钾溶液浓度的方法原理及滴定条件。 3.掌握用高锰酸钾法测定过氧化氢含量的原理和方法。 二、实验原理 标定高锰酸钾溶液的基准物质有H2C2O4·2H2O、Na2C2O4、FeSO4·7H2O、 (NH4)2SO4·6H2O、As2O3和纯铁丝等。由于前两者较易纯化,所以在标定高锰酸钾时经常采用。 本实验采用Na2C2O4标定预先配好的浓度近0.02mol/L的高锰酸钾溶液,两者反应方程式如下:2KMnO4+5Na2C2O4+8H2SO4===2MnSO4+8H2O+10CO2↑+5Na2SO4+K2SO4 H2O2是一种常用的消毒剂,在医药上使用较为广泛。在酸性条件下,可用KMnO4标准溶液直接测定H2O2,其反应如下:2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O 此反应可在室温下进行。开始时反应速度较慢,随着Mn2+的产生反应速度会逐渐加快。因为H2O2不稳定,反应不能加热,滴定时的速度仍不能太快。测定时,移取一定体积H2O2的稀释液,用KMnO4标准溶液滴定至终点,根据KMnO4溶液的浓度和所消耗的体积,计算H2O2的含量。 注:1.用KMnO4溶液滴定H2O2时,不能用HNO3或HCl来控制溶液酸度。 2.H2O2样品若系工业产品,常加入少量乙酰苯胺等稳定剂,这时会造成误差,可改用碘量法测定。 三、仪器和药品 仪器:电子天平、称量瓶、50mL酸式滴定管、10、25、50mL移液管、 50mL量筒、电炉、2 mL刻度吸管、250mL容量瓶 试剂:3mol·L-1 H2SO4 、0.02 mol·L-1 KMnO4标准溶液、Na2C2O4、 过氧化氢样品(质量分数约为30%) 四、内容及步骤 1、0.02 mo·L-1 KMnO4溶液的配制 用台秤称取约1.7g KMnO4溶于500 mL水中,盖上表面皿,加热煮沸1h,煮时及时补充水。静置一周后,用玻璃砂芯漏斗过滤,保存于棕色瓶中待标定。 2、KMnO4溶液浓度的标定 准确称取0.15~0.20g Na2C2O4基准物质于250mL锥形瓶中,加水约20mL使之溶解,再加10mL3mol·L-1的H2SO4溶液,并加热至75~85℃,立即用待标定的KMnO4溶液滴定,滴至溶液呈淡红色并经30s不褪色,即为终点。平行测定3次,根据滴定所消耗KMnO4溶液体积和基准物的质量,计算KMnO4溶液的浓度。
过氧化氢含量的测定
过氧化氢含量的测定 取适量过氧化氢,硫酸酸化,加入适当过量的碘化钾,再用硫代硫酸钠标准溶液滴定至黄色很浅,加入可溶性淀粉,至蓝色褪去为终点,标定硫代硫酸钠可使用重铬酸钾或碘酸钾,加入过量碘化钾,再重复上述操作。 实验原理 H?O?于其氧化还原性,广泛应用于漂白、消毒、杀菌医药等工业,因此常需要测定它的含量。 H?O?分子中含有一个过氧键-O-O-,既可在一定条件下作为氧化剂,又可在一定条件下作为还原剂。在稀硫酸介质中,在室温条件下KMnO?可将其定量氧化,因此可用高锰酸钾法测定过氧化氢含量,其反应式为: 滴定在酸性溶液中进行,反应时锰的氧化数由+7变到+2。开始时反应速度慢,滴入的KMnO?溶液褪色缓慢,待有Mn2?生成后,由于Mn2?的催化作用,反应速度加快,故能顺利滴定,当滴定至溶液中有稍过量的滴定剂MnO?—(2*10-6 mol/L)时,溶液呈现微红色,显示终点。根据KMnO?溶液的浓度和滴定消耗的体积,即可计算H?O?的含量。 试剂及仪器 试剂:Na?C?O?基准物质、0.02 mol/L 的KMnO?溶液、3 mol/L 的H?SO?溶液、双氧水样品(约30%H?O?水溶液)等。 仪器:分析天平、称量瓶、锥形瓶、酸式滴定管、容量瓶、移液管、
洗瓶等。 实验步骤 KMnO?溶液(0.02 mol/L)的配制 称取KMnO?固体约1.6克溶于水500ml水中,盖上表面皿,加热至沸并保持微沸1小时,冷却后用微孔玻璃漏斗(3号或4号)过滤。滤液贮存于具塞棕色瓶中,室温下静置2-3天后过滤备用。KMnO?溶液的标定 准确称取0.15-0.20gNa?C?O?三份,分别置于250ml锥型瓶中,加水50ml使其溶解,加入10mL 3 mol/L H2SO4 溶液,在水浴上加热到75-85℃(即开始冒蒸气时温度),趁热用待定的KMnO?溶液滴定,开始时滴定速度要慢,待溶液中产生了Mn2?后,滴定速度可适当加快,但仍须逐滴加入,加至溶液呈现微红色并持续分钟内不褪色即为终点。根据Na?C?O?的重量和KMnO?滴定消耗的体积,即可计算KMnO?溶液的浓度。 H?O?含量的测定 用移液管吸取1mL 30% H?O?,置于250mL容量瓶中,定容。用移液管吸取25.00mL上述溶液置于250mL锥型瓶中,加水20mL,3mol/L 的H?SO?溶液10mL,用KMnO?标准溶液滴定至微红色,半分钟内不褪色即为终点。计算试样中H?O?的质量体积百分比。 式中C(KMnO?)为KMnO?溶液的浓度(mol/L),V(KMnO?滴定H?O ?消耗的KMnO?溶液体积(ml),M(H?O?)为H?O?的摩尔质量。
实验六双氧水中H2O2含量的测定—KMnO4法
实验六双氧水中H2O2含量的测定—KMnO4法 教学目标及基本要求 1、掌握KMnO4标准溶液的配制和标定方法。 2、学习KMnO4法测定H2O2含量的方法。 教学内容及学时分配 1.分析强调上次实验报告中出现的问题和注意事项,提问检查预习实验情况,0.2学时。 2. 讲解实验内容(0.8学时):高锰酸钾溶液的配制和标定方法;利用高锰酸钾法测定双氧水中H2O2含量。 1.开始实验操作,指导学生实验,发现和纠正错误,3学时。 一、预习内容 1、氧化还原滴定法的应用—KMnO4法(p158) 二、实验目的 1、掌握KMnO4标准溶液的配制和标定方法。 2、学习KMnO4法测定H2O2含量的方法。 三、实验原理 双氧水是医药卫生行业广泛使用的消毒剂,主要成分为H2O2,本身具有强氧化性,但遇到氧化性更强的KMnO4时,H2O2表现出还原性,二者发生的反应如下: MnO4-+H2O2+6H+=2Mn2++5O2↑+8H2O 该反应在酸性溶液中进行,反映开始速率很慢,待Mn2+生成后,由于Mn2+的催化作用反应速率加快。当达化学计量点时,微过量的KMnO4使溶液显微红色,指示终点到达。在生物化学中常用这种方法测定过氧化氢酶的活性。在血液中加入一定量的过氧化氢,由于过氧化氢酶能使过氧化氢分解,作用完后,在酸性条件下,用KMnO4滴定剩余的H2O2,就可以了解过氧化氢酶的活性。 四、实验步骤 1、KMnO4标准溶液的配制 (1)配制500cm3浓度为0.02 mol dm-3的KMnO4溶液 计算需称取KMnO4固体的质量:0.02×500×10-3×158=1.6(g) 用台秤粗略称取1.7g KMnO4固体置于烧杯中,加煮沸并冷却的水500cm3,搅拌至完全溶解,转入棕色试剂瓶中于暗处保存7~10天使溶液中的还原性杂质完全氧化。用玻璃砂芯漏斗过滤,弃去残渣和沉淀,将滤液置于棕色试剂瓶中。 (2)标定 本实验中标定KMnO4溶液所用的基准物质为Na2C2O4,二者发生的反应为:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O 计算需要称取Na2C2O4的质量: 若消耗KMnO4溶液的体积为20.00cm3,
双氧水的测定
过氧化氢的测定 查原辅料品质规格单,确定需测理化指标: 双氧水含量 ≥35.0% PH 值 ≤4.0 稳定性 ≥95.0% 一、双氧水含量的测定 1.试剂准备 (1)0.1N 高锰酸钾标准滴定溶液 a.溶液配制 称取3.3g 高锰酸钾,溶于1050ml 水中,缓缓煮沸15min,于暗处放置两周,抽滤,储存于棕色瓶中。 b.标定 称取0.25于105℃-110℃马弗炉中干燥至恒重的工作基准试剂草酸钠,溶于100ml 硫酸溶液(8+92)中,用配制好的高锰酸钾溶液滴定,近终点时加热至约65℃,继续滴定至溶液呈粉红色,并保持30s 不变色。同时做空白试验。 高锰酸钾标标准滴定溶液的浓度c ( KMnO 451),数值以摩尔每升(mol/L )表示; M m c v v KMnO )(1000)51(214-?= 式中 v 1——高锰酸钾的体积的数值,ml v 2 ——空白试样高锰酸钾的体积的数值,ml m ——草酸钠的质量的准确数值,g M ——草酸钠的摩尔质量的数值,g/mol (M (O C Na 4222 1)=66.999) (2)12N 硫酸(在500ml 容量瓶中加入250ml 去离子水,然后慢慢加入170ml 浓硫酸,溶解后用去离子水稀释至刻度,摇匀) 2.分析步骤 (1)称取1.000g(设为m ,准至0.001g) 双氧水,用50ml 去离子水溶解,定容至100ml 的容量瓶,摇匀。 (2)移取10ml 上述稀释液至250ml 锥形瓶中,加入50ml 去离子水,10ml 12N 硫酸。 (3)用0.1N 高锰酸钾标准滴定溶液滴定至溶液刚好呈粉红色,记录所消耗的高锰酸钾的体积。 (4) 做空白试验。 3.计算公式 双氧水的质量分数w ,数值以%表示; m c M w v v )(21-=
过氧化氢含量的测定
过氧化氢含量的测定 过氧化氢(Hydrogen peroxide) 化学式: H2O2过氧化氢含量测定,过氧化氢含量,H2O2过氧化氢含量测定,过氧化氢含量,H2O 相对分子质量: 34.01 结构式: 说到过氧化氢,可能很多小伙伴会想就是实验室里那种俗称双氧水,外观为无色透明需要避光的液体。它是一种强氧化剂,其水溶液适用于医用伤口消毒及环境消毒和食品消毒。然鹅,过氧化氢可没这么简单,它在生物体内广泛存在,而且是一种关键的调节因子。过氧化氢含量与细胞状态有密切关系呢。 可能有人不理解这种强氧化剂咋会在生物体内存在,我们就来说说: 过氧化氢是生物体内最常见的活性氧分子,是一种活性氧代谢的副产物,主要由S OD 和XOD 等催化产生,由CAT 和POD 等催化降解。过氧化氢不仅是重要的活性氧之一,也是活性氧相互转化的枢纽。一方面,H2O2 可以直接或间接地氧化细胞内核酸,蛋白质等生物大分子,并使细胞膜遭受损害,从而加速细胞的衰老和解体;另
一方面过氧化氢也是许多氧化应急反应中的关键调节因子。过氧化氢可以激活NF-κB 等因子,这些过氧化氢相关的信号途径和哮喘、炎症性关节炎、动脉硬化以及神经退行性疾病等许多疾病相关。过氧化氢也和细胞凋亡、细胞增殖等密切相关。 看来过氧化氢在生物体内确实发挥重要作用呢,所以过氧化氢含量的测定就有重要的意义。我们下面简单介绍几种常用的测定过氧化氢的方法: 一、二甲酚橙(xylenol orange)法 这种方法在国内应用比较广泛,有明显的优势。 原理:过氧化氢氧化二价铁离子产生三价铁离子,二甲酚橙(xylenol orange)高选择性的结合三价铁离子形成有色(紫色)产物,可用比色法在580nm处测定。从而实现对过氧化氢浓度的测定。 由于二甲酚橙(xylenol orange)作为一种金属离子络合指示剂,与三价铁离子的结合有很高的选择性,也就是该方法有很好的特异性。同时该反应需要在酸性条件下进行,可以消除很多物质的干扰。 二、硫酸钛比色法
双氧水中过氧化氢含量的测定
市售双氧水中过氧化氢含量的测定 一、实验目的 1、了解KMnO4溶液配制和标定的原理、方法; 2、熟悉自身指示剂和自动催化的含义。 3、掌握KMnO4法测定H2O2的原理、方法。 二、实验原理 1、高锰酸钾溶液的配制 KMnO4是强氧化剂,常含有杂质,不能直接配制标准溶液。蒸馏水中常含有少量的还原性物质,使KMnO4还原为MnO2·nH2O,它能加速KMnO4的分解,故要将KMnO4溶液煮沸一段时间,放置几天,使之充分反应过滤后,才能标定。 2、浓度标定 标定KMnO4溶液常用分析纯Na2C2O4,在酸性溶液中反应如下式: 2 MnO4- + 5C2O42- + 16 H+ == 2 Mn2++ 8 H2O + 10CO2↑ (紫色)(肉色) 此标定反应要在H2SO4酸性、溶液预热至75o~85℃和有Mn2+催化的条件下进行。滴定开始时,反应很慢,KMnO4溶液必须先加入1滴,待退色后再逐滴加入,如果滴加过快,KMnO4在热、酸溶液中能部分分解而造成误差: 4 KMnO4 + 6 H2SO4= 2K2SO4 + 4MnSO4 + 6H2O + 5O2↑ 在滴定过程中(保持溶液温度:温低反应慢,温高H2C2O4分解),溶液中生成了Mn2+,使反应速度加快(自动催化),所以滴定速度可稍加快些,以每秒2~3滴为宜。由于KMnO4溶液本身具有颜色,滴定时溶
液中有稍微过量的MnO 4- 即显粉红色,故不需另加指示剂(自身指示剂)。 KMnO 4溶液准确浓度按下式计算: 1000524 4 224224??? = KMnO O C Na O C Na KMnO V M m c 3、过氧化氢含量的测定 H 2O 2在酸性溶液中是强氧化剂,但遇KMnO 4时表现为还原剂。在酸性溶液中H 2O 2很容易被KMnO 4氧化,反应式如下: 2MnO 4- + 5H 2O 2 + 6H + = 2Mn 2+ + 8H 2O + 5O 2↑ (紫红) (肉色) 该反应同样具备自身催化和自身指示剂这两个特点。 开始时,反应很慢,待溶液中生成了Mn 2+,反应速度加快(自动催化反应),故能顺利地、定量地完成反应。稍过量的滴定剂(2×10-6mol/L )显示它本身颜色(自身指示剂),即为终点。 H 2O 2的浓度(mg ·L -1)按下式计算: 样V M V c O H KMnO KMnO O H 1 00.250.2502 5224 42 2 ??? = ρ 三、实验仪器与试剂 棕色试剂瓶(500ml ),锥形瓶(250ml ),刻度移液管(1ml ,25ml ),容量瓶(250ml ),酸式滴定管(25ml ); 3mol/LH 2SO 4,双氧水,蒸馏水。
双氧水浓度测定
一、双氧水浓度测定 双氧水是一种氧化性漂白剂,为无色水溶液,市场上双氧水的浓度一般为27.5%、30%等,目前双氧水是棉及棉型织物应用最广泛的漂白剂。双氧水有较强的腐蚀性,在测定浓度时应格外小心。测试中用高锰酸钾标准溶液来标定,其反应方程式如下: 2KMnO 4+5H 2O 2+3H 2SO 4 = 2MnSO 4+K 2SO 4 +5O 2+8H 2O 滴定时由于高锰酸钾溶液自身就为指示剂,当溶液呈现微红色时,即为终点,记下所消耗高锰酸钾标准溶液的读数V ,可根据读数来计算草酸的浓度。 1.主要仪器和设备 酸式滴定管、滴定架、锥形瓶、移液管、洗耳球、量筒、水浴锅、滤纸 2.测试液准备 高锰酸钾标准溶液(浓度0.0588mol/L ); 20%硫酸溶液。 3.测试步骤 (1)吸取双氧水溶液5mL ,置于250mL 锥形瓶中,加蒸馏水100mL 及10mL20%硫酸,在锥形瓶下放一白纸(观察颜色变化更敏锐)。 (2)在水浴锅中将锥形瓶内的溶液加热至30~40℃ (3)将高锰酸钾标准溶液放置于酸式滴定管中,调零至0.00mL 。 (4)用高锰酸钾标准溶液滴定溶液呈现微红色,并在30秒内不消失,即为终点,记下高锰酸钾用量V (保留两位小数)。 4.计算 双氧水浓度(g/L )= 双氧水溶液 V V KMnO c 3425)(4??? = V 式中:C(KMnO 4):高锰酸钾标准溶液的浓度,mol/L ; V :消耗高锰酸钾标准溶液的体积,mL ; 34:双氧水的摩尔质量,g/mol ; V 双氧水溶液:双氧水测试液体积,mL 。 如双氧水浓度 = 1 g/L , 则需要加双氧水多少才能到达8g/L ? 解:轧漂时轧槽的体积为:300L , 则(8-1)×300 = 2100 g = 2.1kg 。 但是市场上的双氧水不是100%,而是35%左右的 因此需加双氧水的量为: 2.1/35% = 6kg 。
过氧化氢含量的测定
国际标准分类中,过氧化氢的测定方法涉及到粉末冶金、食品试验和分析的一般方法、有色金属、耐火材料、消毒和灭菌、空气质量、职业安全、工业卫生、消防、电击防护、危险品防护、计量学和测量综合、化工技术、有机化学、水质、无机化学。 在中国标准分类中,过氧化氢的测定方法涉及到粉末冶金分析方法、基础标准与通用方法、贵金属及其合金分析方法、贵金属及其合金、碱性耐火材料、轻金属及其合金分析方法、耐火材料综合、制糖、公共医疗设备、劳动卫生、水环境有毒害物质分析方法、氧化物、单质、表面活性剂、大气环境有毒害物质分析方法、工业废水、污染物分析方法、室外给水、排水工程。 中华人民共和国国家质量监督检验检疫总局、中国国家标准化管理委员会,关于过氧化氢的测定方法的标准 ?GB/T 5124.4-2017 硬质合金化学分析方法第4部分:钛量的 测定过氧化氢分光光度法 国家质检总局,关于过氧化氢的测定方法的标准 ?GB/T 23499-2009 食品中残留过氧化氢的测定方法 ?GB/T 15072.12-2008 贵金属合金化学分析方法.银合金中钒 量的测定.过氧化氢分光光度法
?GB/T 5069.9-2001 镁质及镁铝(铝镁)质耐火材料化学分析方法过氧化氢光度法测定二氧化钛量 ?GB/T 6987.31-2001 铝及铝合金化学分析方法过氧化氢分光光度法测定钛量 ?GB/T 6900.5-1986 粘土、高铝质耐火材料化学分析方法过氧化氢光度法测定二氧化钛量 ?GB/T 23195-2008 蜂花粉中过氧化氢酶的测定方法紫外分光光度法 ,关于过氧化氢的测定方法的标准 ?IRAM 5551-1952 动物脂肪中过氧化氢数量的测定方法 美国材料与试验协会,关于过氧化氢的测定方法的标准 ?ASTM E475-2016 采用气相色谱法测定二叔丁基过氧化氢的标准试验方法 ?ASTM D6363-1998(2009)e1 用过氧化物酶荧光法测定大气水样中过氧化氢和合成有机过氧化物的标准试验方法?ASTM D6363-1998(2003)e1 通过过氧化物酶荧光法对大气水样品中过氧化氢和结合的有机过氧化物测定的标准试验方法?ASTM D6363-1998 通过过氧化物酶荧光法对大气水样品中过氧化氢和结合的有机过氧化物测定的标准试验方法
食品中双氧水残留量的检测
1 食品中双氧水残留量的检测 1.1主要试剂 高锰酸钾标准溶液:使用分析纯高锰酸钾配制成0.1mol/L标准溶液,用草酸钠标准溶液标定。 草酸钠标准溶液:使用基准草酸钠配制成0.1mol/L标准溶液。 1.2主要仪器 电子分析天平、真空泵、离心机(3000转/分)、酸式滴定管、电炉 1.3方法原理 取3份样品,第1份不经加热处理,第2份加热除去双氧水,第3份加热蒸馏取馏出液测定,前两份样品消耗高锰酸钾标准溶液(或草酸标准溶液)量的差再减去第3份试样所消耗的高锰酸钾标准溶液的体积,计算出双氧水的含量。 化学方程式:H2O2+KMnO4+4H+=MnO2+2KOH+2H2O 1.4 分析步骤 1.4.1样品处理 1.4.1.1对于澄清透明的液态样品,分别吸取样品25ml样品用于检测。 1.4.1.2对于非澄清的液态样品,吸50ml样品于100ml容量瓶中,加10.6%亚铁氰化钾溶液和20%乙酸锌溶液各4ml,摇匀,静置,过滤。吸取25ml滤液用于检测。 1.4.1.3对于脂肪含量高的样品,称取2~5克样品,于烧杯中加水搅拌萃取,然后用滤纸过滤,并用水反复冲洗滤纸上的残留物,收集水相定容至100ml, 吸取25 ml (或50ml)用于检测。 1.4.2测定 将第1份样品预处理后,在室温下加50ml水和10ml 1+1硫酸溶液,用0.2mol/L的高锰酸钾标准溶液滴定至微红色出现,30秒不退色为止。 第2份样品预处理后,加热煮沸10分钟,冷却后从上一步的“加50ml水”开始操作。 第3份样品处理后的试液置于全玻璃蒸馏装置中,加150ml水,加热蒸馏,收集约100ml 馏出液,从第1份样品中操作方法的“10ml 1+1硫酸溶液”开始操作。 1.4.3 计算公式 食品中双氧水含量 (V1-V2-V3)×c×34.0 V0 式中:V0——检测时所吸取的原始样品的体积(ml); V1——滴定冷试液所消耗的高锰酸钾标准溶液的体积(ml); V2——滴定加热煮沸后的试液所消耗的高锰酸钾标准溶液的体积(ml); V3——滴定收集的挥发酸馏出液所消耗的高锰酸钾标准溶液的体积(ml); c——高锰酸钾标准溶液的浓度(mol/L); 34.0——1摩尔过氧化氢的质量(g/mol)。
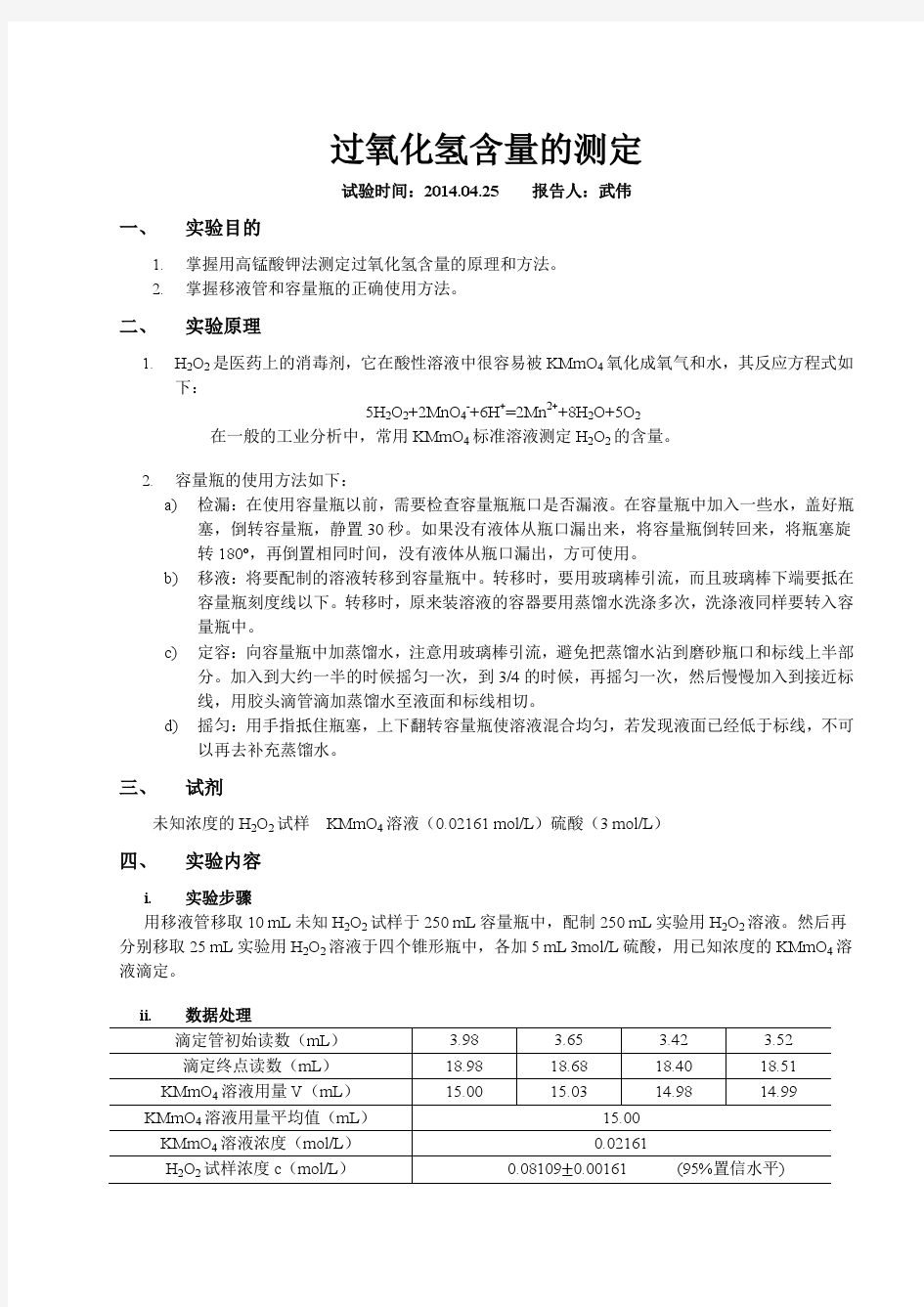
(整理)过氧化氢含量的测定
过氧化氢含量的测定 试验时间:2014.04.25 报告人:武伟 一、实验目的 1.掌握用高锰酸钾法测定过氧化氢含量的原理和方法。 2.掌握移液管和容量瓶的正确使用方法。 二、实验原理 1.H2O2是医药上的消毒剂,它在酸性溶液中很容易被KMmO4氧化成氧气和水,其反应方程式如 下: 5H2O2+2MnO4-+6H+=2Mn2++8H2O+5O2 在一般的工业分析中,常用KMmO4标准溶液测定H2O2的含量。 2.容量瓶的使用方法如下: a)检漏:在使用容量瓶以前,需要检查容量瓶瓶口是否漏液。在容量瓶中加入一些水,盖好瓶 塞,倒转容量瓶,静置30秒。如果没有液体从瓶口漏出来,将容量瓶倒转回来,将瓶塞旋 转180,再倒置相同时间,没有液体从瓶口漏出,方可使用。 b)移液:将要配制的溶液转移到容量瓶中。转移时,要用玻璃棒引流,而且玻璃棒下端要抵在 容量瓶刻度线以下。转移时,原来装溶液的容器要用蒸馏水洗涤多次,洗涤液同样要转入容 量瓶中。 c)定容:向容量瓶中加蒸馏水,注意用玻璃棒引流,避免把蒸馏水沾到磨砂瓶口和标线上半部 分。加入到大约一半的时候摇匀一次,到3/4的时候,再摇匀一次,然后慢慢加入到接近标 线,用胶头滴管滴加蒸馏水至液面和标线相切。 d)摇匀:用手指抵住瓶塞,上下翻转容量瓶使溶液混合均匀,若发现液面已经低于标线,不可 以再去补充蒸馏水。 三、试剂 未知浓度的H2O2试样KMmO4溶液(0.02161 mol/L)硫酸(3 mol/L) 四、实验内容 i.实验步骤 用移液管移取10 mL未知H2O2试样于250 mL容量瓶中,配制250 mL实验用H2O2溶液。然后再分别移取25 mL实验用H2O2溶液于四个锥形瓶中,各加5 mL 3mol/L硫酸,用已知浓度的KMmO4溶液滴定。
过氧化氢含量的测定
过氧化氢含量的测定 一、实验目的 1.掌握用KMnO 4法直接滴定H 2O 2的基本原理和方法。 2.掌握用吸量管移取试液的操作。 二、实验原理 在强酸性条件下,KMnO 4与H 2O 2进行如下反应: 2 KMnO 4 +5 H 2O 2 + 3 H 2SO 4= 2MnSO 4+ K 2 SO 4 + 5O 2↑+ 8H 2O KMnO 4自身作指示剂。 三、试剂 1.KMnO 4标准滴定溶液c (1/5 KMnO 4)=0.1mol/L 。 2.H 2SO 4(3 mol/L )。 3.双氧水试样。 四、实验内容 用吸量管准确量取2.00mL(或准确称取2g)双氧水试样,放入装有200mL 水的250mL 容量瓶中,用水稀释至刻度,摇匀。 用移液管吸取上述试液25.00mL ,置于锥形瓶中,加20mL H 2SO 4(3 mol/L ),用c (1/5 KMnO 4)= 0.1mol/L KMnO 4标准滴定溶液滴定至溶液呈浅粉色,保持30s 不褪为终点。平行测定三次。 五、计算公式 3442222344222211 c(KMnO )[V(KMnO )-V()]10M(H O ) 52ω(H O )100% 25 m()250 11 c(KMnO )[V(KMnO )-V()]10M(H O ) 52ρ(H O )1000 25 V()250 --??=????=?? 空白样品空白样品 式中 ω(H 2O 2)——过氧化氢的质量分数,%; ρ(H 2O 2)——过氧化氢的质量浓度,g/L ; c (1/5KMnO 4)——KMnO 4标准滴定溶液的浓度,mol/L ; V (KMnO 4)——滴定时消耗KMnO 4标准滴定溶液的体积,mL ; V (空白)——空白试验滴定时消耗KMnO 4标准滴定溶液的体积,mL ; m (样品)——H 2O 2试样的的质量,g ; V (样品)—— H 2O 2试样的体积,mL ; M (1/2H 2O 2)——1/2H 2O 2的摩尔质量,g /mol 。 六、数据记录
KMnO4溶液的标定及H2O2含量的测定
实验六 KMnO4溶液的标定及H2O2含量的测定 一、实验目的 1.掌握以Na2C2O4为基础标定KMnO4溶液浓度的方法原理及滴定条件 2.掌握用KMnO4法测定H2O2含量原理和方法 重点: 滴定条件的掌握。尤其是速度。 难点: 滴定时温度、速度的控制;深色溶液在滴定管中的读数。 二、实验原理 H2O2在工业、生物、医药等方面应用很广。利用H2O2的氧化性漂白毛、丝织物;医药上常用于消毒和杀菌;纯H2O2用作火箭燃料的氧化剂;工业上利用H2O2的还原性除去氯气H2O2+CI2=2 CI-+2H++O2 植物体内的过氧化氢酶也能催化H2O2的分解反应,故在生物上利用此性质测量H2O2分解所放出的氧来测量过氧化氢酶的活性,由于H2O2有着广泛的应用,常需要测定它的含量。 H2O2样品若系工业样品,用KMnO4法测定不合适,因为产品中常加有少量乙酰笨胺等有机物作稳定剂,滴定时也要消耗KMnO4溶液,引起方法误差,如遇此情况,应采用碘量法或铈量法进行滴定 H2O2分子中有一个过氧键—O—O—,在酸性溶液中它是一个强氧化剂。但遇KMnO4表现为还原剂。在稀H2SO4溶液中,H2O2在室温条件下,能定量地被KMnO4氧化而生成O2和H2O,其反应式如下: 5H2O2 +2 MnO4-+6H+=2 Mn2++5O2+8H2O n H2O2:n KMnO4=5:2 n H2O2=5/2 n KMnO4 为了加快反应速度,我们加入MnSO4作为催化剂。 三、试剂与仪器 1.仪器:(每人) (1)100mL量筒1个 (2)锥形瓶3个 (3)50或100mL烧杯1个 (4)25mL量筒1个(量15mL1:5H2SO4溶液) (5)10mL移液管1支 (6)250mL容量瓶1个、100 mL容量瓶1个 (7)5mL吸管1支 (8)恒温水浴锅 2.试剂 (1)Na2C2O4 (2)1:5H2SO4 (3)0.02mol/LKMnO4 (4)H2O2 (5)1mol/LMnSO4(摩尔质量151.00,7.6克——50mL)
