AOAC 996.08 食物中的沙门氏菌--AOAC Official Method 996.08 Salmonella in Foods

17.9.14A
AOAC Official Method996.08
Salmonella in Foods
Enzyme-Linked Immunofluorescent Assay
Screening Method
(VIDAS?Salmonella[SLM]Assay)
First Action1996
Method tests for presence of Salmonella in all foods.Certain per-centage of false-positive reactions may be encountered.All positive assays must be confirmed by standard culture methods.Enrichment and M broths must be streaked on selective media as in967.26B(see 17.9.07)and typical or suspect colonies must be identified as in 967.26C(see17.9.02),967.27(see17.9.03),and967.28(see 17.9.07).Alternatively,for presumptive generic identification of foodborne Salmonella,use commercial biochemical kits as de-scribed in978.24(see17.9.04),989.12(see17.9.05),and991.13 (see17.9.06).
Caution:See Appendix B,safety notes on handling microorgan-isms.Some reagents contain0.1%sodium azide.Avoid
contact with skin and eyes.In case of contact,immedi-
ately flush contact surfaces with plenty of water.Dis-
posal of these reagents into sinks with copper or lead
plumbing should be followed immediately with large
quantities of water to prevent potential hazards.
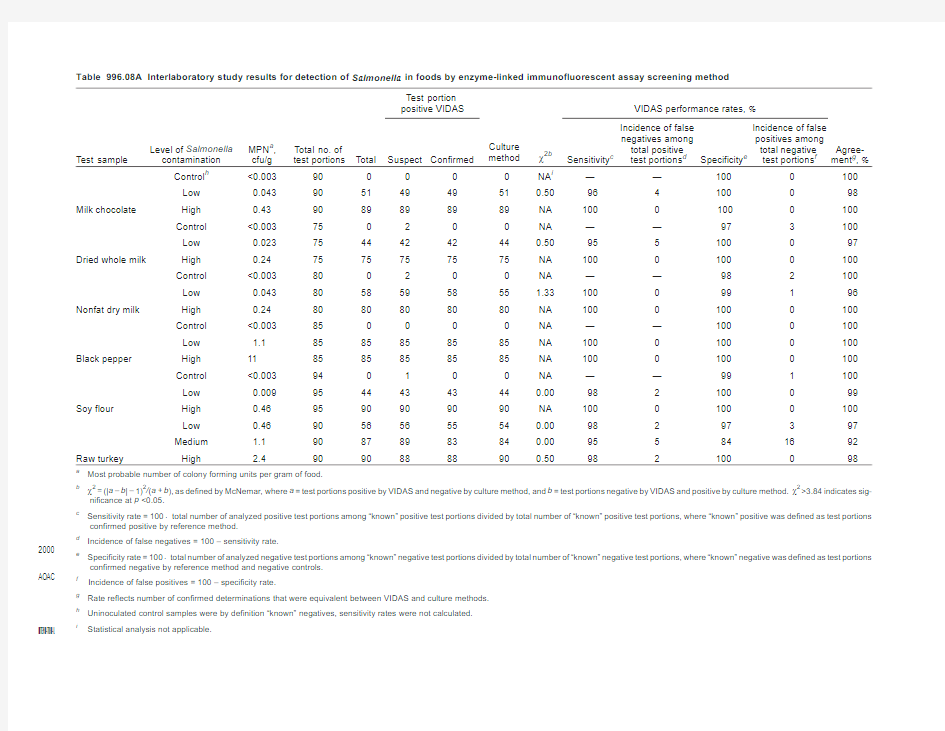
See Table996.08A for the results of the interlaboratory study sup-porting the acceptance of the method.
A.Principle
Identification of Salmonella antigens is based on enzyme-linked fluorescent immunoassay performed in automated VIDAS instru-ment.Pipet tip-like device,solid-phase receptacle(SPR),serves for the assay as solid phase as well as pipet.SPR is coated with mixture of highly specific monoclonal antibodies.All steps of assay are performed automatically.Following pre-enrichment,selective en-richment,and post-enrichment of test portions,aliquot of boiled broth is placed into reagent strip and mixture is cycled in and out of SPR for specific length of time.Salmonella antigens,if present, bind to monoclonal antibodies coating interior of SPR.All other unbound compounds are washed away.Antibodies conjugated with alkaline phosphatase are cycled in and out of SPR,binding to any Salmonella antigen bound to SPR wall.Final wash step removes unbound conjugate.The substrate,4-methyl umbelliferyl phos-phate,is converted by enzyme on SPR wall to the fluorescent prod-uct,4-methyl umbelliferone.Intensity of fluorescence is measured by optical scanner.Results are analyzed automatically by computer; test value based on fluorescence measurement is generated,com-pared to a standard,and then positive or negative report is printed for each test sample.
B.Reagents
(a)Reagent strips.—Sixty polypropylene strips of10wells,each strip covered with foil seal and proper label.See Table996.08B for reagents included in10-well strip.
(b)SPR.—Sixty,coated with anti-Salmonella antibodies.
(c)Antigen standard solution.—One bottle(3mL).Contains pu-rified and inactivated Salmonella antigen with0.1%sodium azide and protein stabilizers.
(d)Positive control.—One bottle(6mL).Contains purified and inactivated Salmonella antigen with0.1%sodium azide and protein stabilizers.
(e)Negative control.—One bottle(6mL).Contains tris buffered saline(TBS)–Tween with0.1%sodium azide.
(f)Package insert.
(g)M broth.—5.0g yeast extract,12.5g tryptone,2.0g D-mannose,5.0g sodium citrate,5.0g NaCl,5.0g K2PO4,0.14g
MnCl2,0.8g MgSO4,0.04g FeSO4,and0.75g Tween80.Suspend ingredients in1L H2O and heat to boiling1–2min.Dispense10mL portions into16×125mm screw cap tubes.Cap tubes loosely and autoclave15min at121°C.Tighten caps securely for storage.Final pH should be7.0±0.2.
(h)Diagnostic reagents.—Necessary for culture confirmation of presumptive positive assays.See967.27(see17.9.03).
Items(a)–(f)are available as VIDAS Salmonella(SLM)assay kit from bioMérieux Vitek,Inc.,595Anglum Rd,Hazelwood, MO63042-2320,USA.Store all materials at2–8°C.Sufficient for 60tests.
C.Apparatus
(a)VIDAS or miniVIDAS automated immunoassay system.—Available from bioMérieux Vitek,Inc.
(b)Incubators.—Maintaining35±1°C and42±1°C.
(c)Water bath.—Maintaining100°C.
D.General Instructions
Components in kit are intended for use as integral unit.Do not mix reagents or disposables of different lot numbers.
Store test kit at2–8°C.Bring reagents to room temperature be-fore use.Mix well antigen standard solution,control solutions, and boiled test broths before use.Immediately after use,place un-used components at2–8°C.
Include one positive and one negative control with each group of tests.
Treat all materials in contact with bacterial cultures as biohazardous material and autoclave after use.
E.Preparation of Test Suspension
(1)Pre-enrichment.—Pre-enrich test sample in nonselective me-dium to initiate growth of salmonellae.Pre-enrichment varies with product type and must be performed as described in967.26(see 17.9.02)or as in Bacteriological Analytical Manual,current edition, AOAC INTERNATIONAL,Gaithersburg,MD20877-2417,USA.
(2)Selective enrichment.—Transfer1mL incubated pre-enrichment culture to tube containing10mL selenite-cystine broth and1mL to tube containing10mL tetrathionate broth.For all foods other than raw foods or foods with a high microbial load,incu-bate selenite-cystine and tetrathionate broths6h at35and42°C,re-spectively.For raw foods or foods with a high microbial load, incubate broths18±2h.
(3)Post-enrichment.—After incubation,transfer1mL tetrathionate culture to tube containing10mL M broth.Transfer 1mL selenite-cystine culture to separate tube containing10mL M broth.For all foods other than raw foods or foods with a high mi-crobial load,incubate M broths18h at42°C.For raw foods or foods with a high microbial load,incubate M broths6h at42°C. Reincubate selenite-cystine broths at35°C and tetrathionate broths at42°C for total incubation time of24±2h.
(4)After post-enrichment incubation.—Transfer1mL of each M broth into separate tubes and heat15min in water bath at100°C.
?2000AOAC INTERNATIONAL
Table996.08B Reagents included in10-well reagent strip
Well Reagent
1Test well.—0.5mL boiled enrichment broth is
placed into well.
2Prewash solution.—Tris buffered saline
(TBS)-Tween with0.1%sodium azide.
3–5and7–9Wash solution.—0.6mL.TBS-Tween with0.1%
sodium azide.
6Conjuate solution.—0.4mL.Alkaline phosphatase
labeled polyclonal antibodies with0.1%sodium
azide.
10Cuvette with substrate.—0.3mL.4-Methyl
umbelliferyl phosphate with0.1%sodium azide.
Store remaining M broths at4°C and use for confirmation of positive
results.
F.Enzyme Immunoassay
(1)Label desired number of reagent strips(one/food test sam-
ple).For each series of test samples,label strips for positive(C1)and
negative(C2)controls,and antigen standard solution(S1)provided
with test kit.Allow strips to equilibrate to room temperature.
(2)Mix each bottle of positive control,negative control,and anti-
gen standard solution.
(3)Pipet0.5mL aliquots of positive and negative controls,anti-
gen standard solution,and each boiled M broth from E(4)into test
wells of reagent strip.
(4)Enter the appropriate assay information to create work list.
Type“SLM”to enter assay code,and type number of tests to be run.
Type“S”for standard and“Pos”and“Neg”for positive and negative
controls.
(5)Load reagent strips and SPRs into positions that correspond to
VIDAS section indicated by the work list.
(6)Initiate assay processing as directed in VIDAS operator’s
manual.The assay should be completed in ca45min.
G.Reading of Results
Test results are analyzed automatically by computer.Printed re-
port includes type of test performed,identification of test sample,
date and time,lot number and expiration date of reagent kit,relative
fluorescence value(RFV)of each test sample,test value,and inter-
preted result.
RFV is final reading of test portion minus background reading;
test value is ratio of RFV to antigen standard.Results are interpreted
after test and control values are compared to threshold value(0.23)
stored in computer.Test is considered negative if test value is<0.23;
test is considered positive if test value is≥0.23.Positive result must
be confirmed following standard plating procedures as described in
967.26B(a)(see17.9.02)using refrigerated M broths from E(4).
Test results are reported as invalid when background reading is
above predetermined cutoff value(indicating low-level substrate
contamination).In such case,repeat assay starting from F(1).
Reference:J.AOAC Int.80,491(1997).
Revised:March1999
?2000AOAC INTERNATIONAL
沙门氏菌的检验
沙门氏菌的检验 食品学院14食品质量与安全1班 刘文敏柳基炜卫杰恒温紫君 2 2 2 2 摘要:本实验采用GB/T4789.4-2010的检测方法测定鸡场中的沙门氏菌。通过本实验学习沙门氏菌的检测方法和技术,了解沙门氏菌的一些生化特性;本实验先用显色培养基找出可疑菌落,再做生化试验找出可疑的典型性的沙门氏菌,再通过血清学试验最终确定是否为沙门氏菌属。 关键词:沙门氏菌接种生化试验血清学鉴定 前言 沙门氏菌病是公共卫生学中具有重要意义的人畜共患病种之一,其病原沙门氏菌属于肠道细菌科。沙门氏菌是一个统称,泛指 2000 多种有紧密连系的细菌,包括引起食物中毒,导致胃肠炎、伤寒和副伤寒的细菌。虽然只有少数人因沙门氏菌而患病,但是,在世界范围内的细菌性食物中毒事件中,由沙门氏菌引起的占大多数。因此,采用科学、合理的方法检验食品中沙门氏菌,已经成为了人们最关心的问题之一[1]。国标法(GB4789.4-2010)是目前中国规定的食品中沙门氏菌的标准检测方法,也是基层实验室普遍采用的检测方法,它根据沙门氏菌的生长特点和生化特性,采取前增菌、增菌、分离、生化试验和血清学鉴定5个步骤进行[2]。 1材料与方法 1.1实验材料 1.1.1仪器设备 均质器、三角烧瓶、平皿、玻璃棒、接种棒 恒温培养箱:36℃±1℃,42℃±1℃ 吸管:1 mL(具 0.01 mL刻度)、10mL(具0.1mL刻度或微量移液器及吸头
电子天平PL602-S,梅特勒-托利多仪器(上海)有限公司; 手提式不锈钢压力蒸汽灭菌锅SYQ-DSX-280B,上海申安医疗器械厂 1.1.2试剂药品 鸡肠、靛基质试剂、沙门氏菌O和H诊断血清、API20E生化试剂盒或VITEKGNI 生化鉴定卡 1.1.3培养基 蛋白胨水(BPW)、四硫磺酸钠煌绿(TTB)、亚硒酸盐胱氨酸(SC)增菌液、亚硫酸铋(BS)琼脂、HE琼脂、三糖铁琼脂、蛋白胨水、尿素琼脂、氰化钾、氰化钾对照、赖氨酸脱羧酶、赖氨酸脱羧酶对照、甘露醇、山梨醇、β-D半乳糖苷(ONPG)培养基 1.2 实验方法 1.2.1培养基的制备 1.2.1.1培养基的配制步骤 蛋白胨水(BPW):称取蛋白胨10g、氯化钠5g、磷酸氢二钠9g、磷酸二氢钠1.5g、蒸馏水1000ml,将各成分加入蒸馏水中,搅混均匀,静置约 10 min,煮沸溶解,调节 pH,高压灭菌 121 ℃,15 min。分装10瓶,每瓶90ml 四硫磺酸钠煌绿(TTB):高压灭菌 121 ℃,15 min灭菌冷却后至30℃,每100ml 基础培养液加碘液2ml,煌绿液1ml 1.2.1.2配制培养基的注意事项 (1)按照说明书上的用量进行换算,称取准确分量的合成培养基粉末; (2)加热煮沸溶解培养基时,留意锅内水位的变化,水位下降可再添加适量的水,以免水分蒸发过多,导致后面分装不够量; (3)往试管中放小导管时,注意处理气泡。 1.2.2 沙门氏菌群检测 1.2.2.1沙门氏菌检测程序
沙门氏菌的检验
沙门氏菌的检验 2.2 恒温培养箱:36 ℃±1 ℃,42 ℃±1 ℃。 2.3 均质器。 2.4 振荡器。 2.5天平:感量0.1 g。 2.6 无菌锥形瓶:容量500 mL,250 mL。 2.7 无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌培养皿:直径90 mm。 2.9 无菌试管:3 mm×50 mm、10 mm×75 mm。 2.10 无菌毛细管。 2.11 pH 计或pH 比色管或精密pH 试纸。 3 培养基和试剂 3.1 缓冲蛋白胨水(BPW):见附录A 中A.1。 3.2 四硫磺酸钠煌绿(TTB)增菌液:见附录A 中A.2。 3.3 亚硒酸盐胱氨酸(SC)增菌液:见附录A 中A.3。 3.4 亚硫酸铋(BS)琼脂:见附录A 中A.4。 3.5 HE 琼脂:见附录A 中A.5。 3.6 木糖赖氨酸脱氧胆盐(XLD)琼脂:见附录A 中A.6。 3.8 三糖铁(TSI)琼脂:见附录A 中A.7。 3.9 蛋白胨水、靛基质试剂:见附录A 中A.8。 3.10 尿素琼脂(pH 7.2):见附录A 中A.9。 3.11 氰化钾(KCN)培养基:见附录A 中A.10。 3.12 赖氨酸脱羧酶试验培养基:见附录A 中A.11。 3.13 糖发酵管:见附录A 中A.12。 3.14 邻硝基酚β-D 半乳糖苷(ONPG)培养基:见附录A 中A.13。 3.15 半固体琼脂:见附录A 中A.14。 3.16 丙二酸钠培养基:见附录A 中A.15。 1 前增菌 称取25 g(mL)样品放入盛有225 mL BPW 的无菌均质杯中,以8 000 r/min~10 000 r/min 均质 1 min~ 2 min,或置于盛有225 mL BPW 的无菌均质袋中,用拍击式均质器拍打1 min~2 min。 2 增菌 轻轻摇动培养过的样品混合物,移取1 mL,转种于10 mL TTB 内,于42 ℃±1 ℃培养18 h~24h。同时,另取1 mL,转种于10 mL SC 内,于36 ℃±1 ℃培养18 h~24 h。 3 分离 分别用接种环取增菌液1 环,划线接种于一个BS 琼脂平板和一个XLD 琼脂平板(或HE 琼脂平板或沙门氏菌属显色培养基平板)。于36 ℃±1 ℃分别培养18 h~24 h (XLD 琼脂平板、
沙门氏菌基本知识及检测方法
沙门氏菌基本知识及检测方法 沙门氏菌属(Salmonella)是肠杆菌科的一个大属,有2000多个血清型,我国发现的约有100个。沙门氏菌广泛存在于猪、牛、羊、家禽、鸟类、鼠类等多种动物的肠道和内脏中。1880年Eberth首先发现伤寒杆菌,1885年Salmon分离到猪霍乱杆菌,由于Salmon发现本属细菌的时间较早,在研究中的贡献较大,遂定名为沙门氏菌属Salmonella 。本属细菌绝大多数成员对人和动物有致病性,能引起人和动物的败血症与胃肠炎,甚至流产,并能引起人类食物中毒,是人类细菌性食物中毒的最主要病原菌之一。 根据沙门氏菌的致病范围,可将其分为三大类群。第一类群:专门对人致病。如伤寒沙门氏菌、副伤寒沙门氏菌(甲型、乙型、丙型)。第二类群:能引起人类食物中毒——食物中毒沙门氏菌群,如鼠伤寒沙门氏菌、猪霍乱沙门氏菌、肠炎沙门氏菌、纽波特沙门氏菌等。第三类群:专门对动物致病,很少感染人,如马流产沙门氏菌、鸡白痢沙门氏菌。致病性最强的是猪霍乱沙门氏菌(Salmonella cholerae),其次是鼠伤寒沙门氏菌(Salmonella typhimurium)和肠炎沙门氏菌(Salmonella enteritidis)。 一、沙门氏菌属的生物学特征: 1.形态染色特性:G-无芽孢杆菌。大小通常为 0.7~1.5μm × 2.0~5.0μm,菌端钝圆,散在,偶有短丝状,无荚膜,除鸡白痢沙门氏菌和鸡伤寒沙门氏菌外均有周身鞭毛,能运动,绝大多数菌株有菌毛。需氧或兼性厌氧菌,生长温度范围为10~42℃,最适生长温度为37℃,适宜pH为6.8~7.8,对营养要求不高,在普通培养基中生长旺盛,胆盐可促进其生长。 2.培养特性:需氧或兼性厌氧菌;生长温度范围为10~42℃,最适生长温度为37℃;适宜pH为6.8~7.8;对营养要求不高,在普通培养基中生长旺盛;胆盐可促进其生长。 §普通琼脂:圆形、光滑、无色半透明、边缘整齐或不太整齐的中等大小(2 ~ 4mm)菌落。鸡白痢、鸡伤寒、猪副伤寒、甲型副伤寒沙门氏菌等只能长成细小菌落。§麦康凯琼脂和伊红美兰琼脂(EMB):菌落无色半透明
关于一起鼠伤寒沙门氏菌引起食物中毒的结案报告
鼠伤寒沙门氏菌引起的一起食物中毒探讨 俞保社庐阳区疾病预防控制中心 沙门氏菌是一大群寄生于人类和动物肠道,其生化反应和抗原构造相似的革兰氏阴性菌。其种类繁多,少数能使人致病,其他可使动物致病,偶尔可传染给人。主要引起人类伤寒、副伤寒以及食品中毒或败血病。在世界各地的食物中毒中,沙门氏菌食品中毒常占首位或者第二位。沙门氏菌菌型繁多,已确认的沙门氏菌有2 500 个以上血型。在常规检测中,血清学作为诊断依据,但经常发生生化符合而血清不凝集的现象。2012年5月25日市一院急诊科收治4名疑似因吃卤菜引起的食物中毒患者,标本检测出现此现象,具体处置如下。 【材料】: 基本情况:发病患者晚上就餐食物为某板鸭店购买的板鸭及家中自备的部分菜。首发病例4小时后出现腹痛、腹泻、发热等不适症状,其余三人陆续出现发类似症状, 4人至合肥市某院急诊科就诊。经流行病学调查:7人于在家就餐,餐后4小时左右陆续发病。最早发病5月24日晚11:30左右(餐后4小时,最先发病的蒋志容据推断应该个体差异的问题对被污染的食物较为敏感,较早地出现了症状。),最迟发病5月25日早晨8时左右(餐后约11时)。发病统计时长约11小时。 样品采集:采集蒋某大便标本1份,胡某大便标本和肛拭子各1份,患者家中剩余板鸭1份、水果刀涂抹样1份,板鸭店砧板、刀具、容器、从业人员手的涂抹样及板鸭各1份共10份样品进行检测。 【实验室检验】: 前增菌:除便样和肛拭子外,样品称取25g放入盛有25mlBPW的无菌均质袋中,用拍击式均质器拍打90S。样品为液态,直接进行培养,于36℃±1℃培养18h。 增菌:轻轻摇动培养过的样品混合物,移取5ml,转种于10mlTTB内;于42℃±1℃,18h~24h培养。同时,另取5ml,转种于10mlSC内,于36℃±1℃,18h~24h培养。 分离:便样和肛拭子直接分离培养,取经TTB增菌液1环,划线接种
MMFSCNJ出口食品中沙门氏菌辛酯酶荧光检验方法
MM_FS_CNJ_0348出口食品沙门氏菌(辛酯酶荧光) MM_FS_CNJ_0348 出口食品中沙门氏菌(辛酯酶荧光)检验方法 1.适用范围 本方法适用于出口肉品,蛋品沙门氏菌的检验,其他食品可参照使用。 2.定义 MUCAP:4-methylumbelliferyl-caprylate(4-甲基伞形酮辛)的缩写。 MUCAP试剂:用4-甲基伞形酮辛酯配成的试剂的缩写。 SS琼脂:沙门氏菌和志贺氏菌琼脂培养基。 HE琼脂:Hektoen Enteric琼脂培养基。 3.主要试剂和仪器 .主要试剂(包括培养基) 培养基与试剂按SN 0170第5章,另补充以下部分: SS琼脂培养基(含1%蔗糖):见附录A1; HE琼脂培养基:见附录A2; MUCAP试剂:见附录A3; 氧化酶试纸:见附录A4; .仪器 紫外光灯:波长366nm,功率>6W; 放大镜:3~4X; 毛细滴管。 4.样品制备及增菌培养 参照SN 0170进行。 5.分离培养 .将增菌培养液摇匀,挑取一接种环,划线接种于SS和HE琼脂培养基各一个,于36±1℃培养24±2h。 .观察各琼脂平板上有无可疑沙门氏菌菌落。如无可疑菌落,应再继续培养24±2h。沙门氏菌的菌落特征见表1。 .从培养的分离培养基上选可疑沙门氏菌菌落(尽量选较大,分离较好的单个菌落),用玻璃笔做好标记并编号。 .用毛细滴管吸取MUCAP试剂,加一滴于编号的菌落上,待一个平板的被检菌全部滴加试剂后,将平板拿至366nm紫外光灯下检视。发蓝色荧光的为MUCAP试验阳性,将阳性菌落号记录下来。 .用接种环挑取荧光反应阳性菌落,涂于氧化酶试纸上,观察涂菌点是否变蓝色。于10min内变蓝色为氧化酶试验阳性;不变色为阴性。 7.结果计算
食物中毒及其预防
食物中毒及其预防 目前国际上有2000种以上的血清型,我国已发现的仅为200多种。依据菌体O抗原结构的差异,将沙门氏菌分为A、B、C1、C2、C3、D、E1、E4、F等血清型,其中对人类致病的沙站氏菌仅占少数。沙门氏菌的宿主特异性极弱,既可感染动物亦可感染人类,极易引起人类的食物中毒。致病性最强的是猪霍乱沙门氏菌,其次是鼠伤寒沙门氏菌和肠炎沙门氏菌。 沙门氏菌属在外界的生活力较强,其生长繁殖的最适温度为20-30℃,在普通水中虽不宜繁殖,但可生存2-3周,在粪便中可生成1-2个月,在土壤中可过冬,在咸肉、鸡和鸭中也可存活很长时间。水经氧化处理5分钟可杀灭沙门氏菌。相对而言,沙门氏菌属不耐热,55℃60℃15-30分钟或100℃数分钟即被杀死。另外,沙门氏菌属不分解蛋白质,不产生靛基质,污染食物后无感观性状变化,易引起食物中毒。 二、流行病学特点 1、季节:全年皆可发生,但多见于夏、秋两季。5-10月发病起数和发病人数可达全年发病总起数和总人数的80%。 2、食品种类:引起沙门氏菌食物中毒的食品主要为动物性食品,特别是畜禽肉类及其制品,其次为蛋类、乳类及其制品,由植物性食品引起者很少见。 3、食品中沙门氏菌的来源:由于沙门氏菌属广泛分布于自然界中,在人和动物中有广泛的宿主,因此,沙门氏菌污染肉类食物的概率很高,如家畜中猪、牛、羊、猫、犬,家禽中鸡、鸭、鹅等。健康家畜
禽肠道沙门氏菌检出率为2-15%,病家率禽肠道沙门氏菌检出率可高达70%,正常人粪便中沙门氏菌检出率仅为002-0。2%,腹泻患者粪便沙门氏菌检出率可达8.6-18.8%。 1)家畜禽的生前感染和宰后污染:生前感染是指家畜禽在宰杀前已感染沙门氏菌,是肉类食品中沙门氏菌的主要来源。它包括原发性沙门氏菌和继发性沙门氏菌病两种。原发沙门氏菌病是指家畜禽在宰杀前已患有沙门氏菌病,如猪霍乱、牛肠炎、鸡白痢等;继发性沙门氏菌病是由于健康家编辑禽肠道沙门氏菌带菌率较高,当患病、饥饿、疲劳或其它原因导致机体抵抗力下降时,寄生于肠道内的沙门氏菌即可经淋巴系统进入血流而引起继发性沙门氏菌感染;由于这些细菌进入动物的血液,内脏和肌肉,其危害较大且发生食物中毒时症状亦较严重。宰后污染是指在屠宰过程中或屠宰后被带沙门氏菌的粪便、容器、污水等污染。 2)乳中沙门氏菌的来源:患沙门氏菌病的奶牛其乳中可能带菌,即使是健康奶牛的乳在挤出后亦可受到污染。 3)蛋类沙门氏菌的来源:蛋类及其制品感染或污染沙门氏菌的机会很多,尤其是鸭、鹅等水禽及其蛋类,带菌率一般在30-40%之间。家禽及蛋类沙门氏菌和原发性感染使卵巢、卵黄或全身带菌外,禽蛋在经泄殖腔排出时,蛋壳表面可在腔门腔里被沙门氏菌污染,沙门氏菌可通过蛋壳气孔侵入蛋内。 4)熟制食品中沙门氏菌的来源:烹调后的熟制食品可再次受到带菌容器,烹调工具和食品从业人员带菌者的污染。
食品中沙门氏菌的污染及预防
食品中沙门氏菌的污染及预防 沙门氏菌是引起人畜共患的食源性病原菌,现已发现的近一千种(或菌株),广泛分布于自然界中。沙门氏菌对禽类,生猪及其鲜肉制品的感染率最高,蛋类,禽类肉制品和猪肉是人类感染沙门氏菌的主要渠道[1]。据统计在世界各种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。我国内陆地区也以沙门氏菌为首位[2]。本文对沙门氏菌的生物学特性,国内外污染情况及控制现状进行了分析,为我国沙门氏菌控制提供理论依据。 1、沙门氏菌的特性: 1.1沙门氏菌的生物学特性: 革兰氏阴性、两端钝圆的短杆菌(比大肠杆菌细),(0.7~1.5μm)×(2~5μm)散在,无荚膜和芽孢,除鸡白痢沙门氏菌、鸡伤寒沙门氏菌外都具有周身鞭毛,能运动,大多数具有菌毛,能吸附于宿主细胞表面或凝集豚鼠红细胞。需氧或兼性厌氧菌;生长温度范围为10~42℃,最适生长温度为37℃;适宜pH为6.8~7.8,需氧及兼性厌氧菌,在普通琼脂培养基上生长良好,培养24h后,形成中等大小、圆形、表面光滑、无色半透明、边缘整齐的菌落,其菌落特征亦与大肠杆菌相似(无粪臭味)。 沙门氏菌绝大多数菌株能发酵葡萄糖,麦芽糖,甘露醇和山梨醇并产生气体,不发酵乳糖、蔗糖和侧金盏花醇,不产吲哚、V-P反应阴性,不水解尿素和对苯丙氨酸不脱氨。 沙门氏菌属不耐热,55℃1h、60 ℃15—30min 即被杀死。在普通水中虽不易繁殖,但可生存2—3周,在粪便、土壤、食品、水中可生存5个月至2年之久。在牛乳和肉类食品中,存活数月,在食盐含量为10%-15%的腌肉中亦可存活2—3个月。烹调大块鱼、肉类食品时,如果食品内部达不到沙门氏菌的致死温度,其中的沙门氏菌仍能存活,食用后可导致食物中毒。冷冻对于沙门氏菌无杀灭作用,即使在-25℃低温环境中仍可存活10个月左右。由于沙门氏菌属不分解蛋白质,不产生靛基质,污染食物后无感官性状的变化,所以其感染易被忽视而引起食物中毒。 1.2沙门氏菌的毒理学特性: 沙门氏菌经口进入人体以后,在肠道内大量繁殖,经淋巴系统进入血液,造成一过性菌血症,即感染过程。随后,沙门氏菌在肠道和血液中受到机体的抵抗而被裂解、破坏,释放大量内毒素,使人体中毒,出现腹泻、发冷、发热及白细胞减少中毒症状。 1.3 沙门氏菌的中毒特点: 沙门氏菌的发病率高,在世界各种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。中毒全年均有发生,多发生于5-10月春夏季节。动物性食品是引起食物中毒的主要食品,其中畜禽肉类及其制品类居首,肉及其制品的沙门氏菌检出率美国为20%—25%、英国为9沙门氏菌.9%、日本检查进口家禽的污染率为10.3%,国内肉类沙门氏菌检出率在 1.1%—39.5%。其次为鱼、奶、蛋类。中国蛋及其制品沙门氏菌检出率为3.9%-43.7%,由于吃蛋引起鼠伤寒病的病例报告逐渐有增加的趋势。 2 、沙门氏菌的污染情况 2.1美国食品中沙门氏菌的污染情况: 沙门氏菌是一种重要的人畜共患病原菌,能够污染多种食物,引起严重的食品安全问题。近年来有关沙门氏菌检出和沙门氏菌中毒事件报道不少。2010年8月17日美国加利福尼亚州卫生部门宣布,加州多个地区暴发沙门氏菌疫情,自6月迄今接到266例患病报告。初步调查显示,多数病人食用鸡蛋后染病。这些鸡蛋可能遭沙门氏菌污染。2012年8月20日,据美国媒体报道,美国州内和联邦政府官员称,全美有20个州出现了沙门氏菌感染病例,已造成2人死亡、141人感染。肯塔基州的感染人数最多,共有50人感染。2013年10月8日美国疾病控制和预防中心公布,迄今,全美18个州共报告278例因食用与生鸡肉有关产
一起由鼠伤寒沙门氏菌引起的食物中毒
一起由鼠伤寒沙门氏菌引起的食物中毒 2007年6月30日,我市郊区某饭店发生一起食物中毒,后经流行病学调查、实验室诊断确 认本次食物中毒系鼠伤寒沙门氏菌污染烧鸡所致。现报告如下。 1 流行病学调查 2007年6月30日,某饭店婚宴就餐人数267人,餐后99人发病,79人住院。无年龄、性别差异。患者潜伏期最短2 h,最长72 h。多数患者初期恶心、头痛、头晕、发冷、全身无力,继而呕吐,剧烈腹痛。腹泻一般6~10次以上,为黄绿色水样便。体温38.5℃~41℃,多数经3~5 d对症治疗全愈。 2 检样 剩余食品、呕吐物、便。 3 实验方法 3.1 镜检将上述样品直接进行革兰氏染色及镜检,镜下可见革兰阴性杆菌及其他杂菌。 3.2 病原菌的分离鉴定按食品卫生微生物学检验[1]进行。 3.2.1 增菌及分离分别将上述检样进行前增菌,37℃培养24 h后再接种于各自的分离平板。经培养后在血平板上未见溶血菌落,排除金黄色葡萄球菌的可能;在亚硫酸铋琼脂平板上有可疑菌落生长,菌落为深棕褐色,周围有黑色圈,对光观察有金属光泽,并为平板上的优势菌,镜检为G-阴性杆菌。 3.2.2 生化试验挑取可疑菌落接种TSI琼脂,培养后取斜面阴性、底层产酸、硫化氢阳性菌落,接种于21种革兰阴性杆菌新编码系列生化培养基,37℃24 h 培养,试验结果:ONPG-,精氨酸+,赖氨酸+,鸟氨酸+,柠檬酸盐+,硫化氢+,尿素-,IPA-,吲哚-,V-P-,明胶-,葡萄糖+,甘露醇+,肌醇+,山梨醇+,鼠李糖+,蔗糖-,密二糖+,苦杏仁甙-,阿拉伯糖-,氧化酶-。编码值6704750,为沙门氏菌。 3.2.3 血清学鉴定用卫生部兰州生物制品研究所生产沙门氏菌属30种诊断血清进行沙门氏菌血清分型,其中O抗原A-F多价凝集,B群O抗原4凝集,H抗原i,2凝集,盐水对照不凝集,鉴定为鼠伤寒沙门氏菌。 4 讨论
沙门氏菌
沙门氏菌 沙门氏菌属肠杆菌科,革兰氏阴性肠道杆菌,己发现1800种以上。除可感染人外,还可感染很多动物包括哺乳类、鸟、爬行类、鱼、两栖类及昆虫。沙门氏菌病是公共卫生学上具有重要意义的人畜共患病之一,人畜感染后可呈无症状带菌状态,也可表现为有临床症状的致死疾,它可能加重病态或死亡率,或者降低动物的繁殖生产力。 沙门氏菌属(Salmonella)是一大群寄生于人类和动物肠道内,生化反应和抗原构造相似的革兰氏阴性杆菌,有的专对人类致病,有的只对动物致病,也有对人和动物都致病,这些统称为沙门氏菌。 沙门氏菌目前已经发现1800种以上,按抗原成分可分为甲、乙、丙、丁、戊等基本菌型。其中与人类疾病有关的主要有甲组的副伤寒甲杆菌,乙组的副伤寒乙杆菌和鼠伤寒杆菌,丙组的副伤寒丙杆菌和猪霍乱杆菌,丁组的伤寒和肠炎杆菌。 此菌可引起禽伤寒、鸡白痢、猪霍乱、鼠伤寒沙门氏菌病、猪副伤寒、马流产沙门氏菌病等疾病。致病性最强的是猪霍乱沙门氏菌(Salmonella cholerae),其次是鼠伤寒沙门氏菌(Salmonella typhimurium)和肠炎沙门氏菌(Salmonella enteritidis)。感染沙门氏菌或食用被带菌者粪便污染的食品,可使人发生食物中毒。据统计在世界各国的种类细菌性食物中毒中,沙门氏菌引起的食物中毒常列榜首。,近日美国多地暴发疑似由生鸡肉引发的沙门氏菌疫情,至少42%患者已入院治疗。数据显示,已有18个州的278人感染具有耐药性的海德堡沙门氏菌。
沙门氏菌属肠道细菌科,包括那些引起食物中毒、导致肠胃炎、伤寒和副伤寒的细菌。能引起食物传播性疾病,近年来,已经成为最常见的食物中毒原因。肠炎沙门氏菌感染通常源于奶制品、禽产品和肉产品;鸡肉和鸡蛋尤其是高风险食品。沙门氏菌感染的症状通常是肠胃出现问题,包括恶心、腹部绞痛、呕吐和腹泻,一般最多持续7天。在免疫力低下的人群中,如果不及时服用抗生素类药品,沙门氏菌感染将导致生命危险。 关注食品安全,关注三方圆
食品中沙门氏菌检验操作规范(已完)
食品中沙门氏菌检验操作规范 1 检验依据 本方法参照GB4789.4-2010《食品安全国家标准食品微生物学检验沙门氏菌检验》。 2 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 2.1 冰箱:2 ℃~5 ℃。 2.2 恒温培养箱:36 ℃±1 ℃,42 ℃±1 ℃。 2.3 均质器。 2.4 振荡器。 2.5 电子天平:感量0.1 g。 2.6 无菌锥形瓶:容量500 mL,250 mL。 2.7 无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌培养皿:直径90 mm。 2.9 无菌试管:3 mm×50 mm、10 mm×75 mm。 2.10 无菌毛细管。 2.11 pH 计或pH 比色管或精密pH 试纸。 2.12 全自动微生物生化鉴定系统。 3 培养基和试剂(按说明书配置或灭菌) 3.1 缓冲蛋白胨水(BPW); 3.2 四硫磺酸钠煌绿(TTB)增菌液; 3.3 亚硒酸盐胱氨酸(SC)增菌液; 3.4 亚硫酸铋(BS)琼脂; 3.5 HE 琼脂; 3.6 木糖赖氨酸脱氧胆盐(XLD)琼脂; 3.7 沙门氏菌属显色培养基; 3.8 三糖铁(TSI)琼脂; 3.9 蛋白胨水、靛基质试剂; 3.10 尿素琼脂(pH 7.2); 3.11 氰化钾(KCN)培养基; 3.12 赖氨酸脱羧酶试验培养基; 3.13 糖发酵管; 3.14 邻硝基酚β-D 半乳糖苷(ONPG)培养基;
3.15 半固体琼脂; 3.16 丙二酸钠培养基; 3.17 沙门氏菌O 和H 诊断血清; 3.18 生化鉴定试剂盒。 4 检验程序 沙门氏菌检验程序见图1。 图1 沙门氏菌检验程序 5 操作步骤 5.1 前增菌 称取25 g(mL)样品放入盛有225 mL BPW 的无菌均质杯中,以8 000 r/min~10 000 r/min 均质1 min~2 min,或置于盛有225 mL BPW 的无菌均质袋中,用拍击式均质器拍打1 min~2 min。若样品为液态,不需要均质,振荡混匀。如需测定pH 值,用1 mol/mL 无菌NaOH 或HCl 调pH 至6.8±0.2。无菌操作将样品转至500 mL 锥形瓶中,如使用均质袋,可直接进行培养,于36 ℃±1 ℃培养8 h~18h。
沙门氏菌检验标准操作规程
1目的P URPOSE 规范888物料、产品的沙门氏菌检验操作,确保检验结果的可靠性。 2范围SCOPE 适用于888物料、产品的沙门氏菌检验工作。 3责任RESPONSIBILITY 微生物检验员严格执行本规程,品质部负责人监督执行。 4程序PROCEDURE 定义和原理 沙门氏菌广泛存在于动物的肠道和内脏,以及被粪便污染的水和土壤中,是细菌性食物中毒的主要病因。本方法利用沙门氏菌呈辛酸酯酶阳性,而氧化酶和脂肪酶均呈阴性的特性,对物料、产品进行沙门氏菌检验。 材料和设备 紫外灯:波长366nm,功率不小于6W。 放大镜:3至4倍。 毛细滴管。 LX-B35L压力蒸汽灭菌锅。 无菌的培养皿。 无菌的接种环。 培养基和试剂 SCDLP液体培养基:按《化妆品卫生规范》(2007版)或使用商品培养基干粉配制。 四硫磺酸钠煌绿(TTB)增菌液:按—2010附录配制或使用商品试剂。 SS琼脂培养基(含1%蔗糖):牛肉浸膏(或牛肉粉),蛋白胨,乳糖,蔗糖,胆盐,柠檬酸钠,硫代硫酸钠,柠檬酸铁,煌绿,中性红,琼脂,蒸馏水1000mL。 HE琼脂培养基:按—2010附录或使用商品培养基干粉配制。 玉米油维多利亚蓝琼脂培养基:灭菌后的基础培养基冷却至50℃左右,边摇边加入玉米油乳化液。倾注平皿,制成平板。基础培养基及玉米油乳化液配方如下: a)基础培养基:蛋白胨5g,酵母浸粉3g,氯化钠5g,琼脂13g,水900mL,。将 各成分加入水中,加热溶解。调节,116℃15min高压灭菌。 b)玉米油乳化液:玉米油100mL,%维多利亚蓝水溶液100mL,%琼脂溶液80mL, 吐温801mL。玉米油加维多利亚蓝水溶液混合,边振动边在沸水中加热溶化。然后, 放入分液漏斗中,弃去蓝色水部分,再将着色的脂肪用水洗1-2次。将着色脂肪20mL 加入810mL琼脂溶液中,再加1mL吐温80,116℃15min高压灭菌。冷却后用超声 波乳化。
MMFSCNJ出口食品沙门氏菌属包括亚利桑那菌检验方法
MM_FS_CNJ_0335出口食品沙门氏菌属(包括亚利桑那菌)检验 MM_FS_CNJ_0335 出口食品沙门氏菌属(包括亚利桑那菌)检验方法 1.适用范围 本方法适用于冻猪肉、冻鸡肉、鸡蛋黄粉和冰鸡蛋白中沙门氏菌属(包括亚利桑那菌)检验。其他食品可参照使用。 2.样品制备及增菌培养 .肉类 如为冷冻产品,应在45℃以下不超过15min,或在2~5℃不超过18h解冻。若不能及时检验,应置于-15℃左右保存。非冷冻而易腐的食品,置于4℃冰箱保存。 以无菌操作,称取剪碎后的瘦肉样品25g,置于灭菌均质杯内,加入25mL缓冲胨水增菌液,以8000~10000r/min均质1min,移入盛有200mL缓冲胨水增菌液的500mL广口瓶内,混合均匀,如pH低于,用灭菌1 mol/L氢氧化钠溶液,调pH至±,于37℃水浴培养4h(以增菌液达到37℃时算起),进行前增菌;其后,移取10mL转种于盛有100mL四硫磺酸盐煌绿增菌液的250mL玻璃瓶内,摇匀,于42±1℃培养20±2h,进行选择性增菌。必要时,同时另称取25g剪碎的瘦肉样品,加入25mL亚硒酸盐胱氨酸增菌液,同样进行均质。其后,移入盛有200ml亚硒酸盐胱氨酸增菌液的500mL广口瓶内,混合均匀,如pH低于,用灭菌1 mol/L氢氧化钠溶液调pH至±,于37℃培养24±2h,进行直接选择性增菌。 .蛋品 冰蛋品(冰鸡全蛋、冰鸡蛋白、冰鸡蛋黄) .按解冻和保存样品。 .以无菌操作称取样品25g,置于盛有225mL四硫磺酸盐煌绿增菌液的500mL广口瓶内混合均匀,如pH低于,用灭菌1mol/L氢氧化钠溶液调pH至±,于37℃培养24±2h,进行直接选择性增菌。 干蛋品(鸡全蛋粉、鸡蛋白片、鸡蛋白粉、鸡蛋黄粉) 以无菌操作将样品碾碎后,称取25g加入盛有225mL缓冲胨水增菌液的500mL广口瓶内(瓶内事先盛有直径3~4mm的玻璃珠约50粒),振荡10min,如pH低于,用灭菌1 mol/L氢氧化钠溶液调pH至±,于37℃培养20~24h,进行前增菌;其后,移取10mL转种于盛有100mL亚硒酸盐胱氨酸增菌液的250mL 玻璃瓶内,混匀,于42±1℃培养20±2h,进行选择性增菌。 3.分离培养 .将增菌培养液摇匀,以无菌操作,用直径3mm的接种环分别挑取1环,分别划线于表面无凝结水的亚硫酸铋和胆硫乳琼脂平板各一个(必要时亚利桑那菌琼脂平板可参照使用),于37℃培养24±2h。 .观察各琼脂平板上有无典型或可疑沙门氏菌属的菌落,如无典型或可疑菌落,应再继续培养24±2h。 沙门氏菌属的菌落特征见表1。 表1.沙门氏菌属菌落特征
实验五食品中沙门氏菌的检验
实验五食品中沙门氏菌的检验 、实验目的要求 1、了解食品的质量与沙门氏菌检验的意义。 2、掌握沙门氏菌的生物学特性。 3、掌握沙门氏菌检验的生化试验的操作方法和结果的判断。 4、掌握沙门氏菌属血清学试方法。 5、掌握食品中沙门氏菌检验的方法和技术。 、原理 沙门菌属是一大群寄生于人类和动物肠道,其生化反应和抗原构造相似的革兰氏阴性杆菌。种类繁多,少数只对人致病。其他对动物致病,偶尔可传染给人。主要引起人类伤寒,副伤寒以及食物中毒或败血症。在世界各地的食物中毒中,沙门氏菌食物中毒常占首位或第二位。 食品中沙门氏菌的检验方法有五个基本步骤:1 前增菌;2 选择性增菌;3 选择性平板分离沙门氏菌;4 生化试验,鉴定到属;5 血清学分型鉴定。目前检验食品中的沙门氏菌是按统计学取样方案为基础,25g 食品为标准分析单位。 三、试剂和仪器 一)最先准备的器材 规格名称数量 1、500ml 广口瓶 1 个 2、500ml 三角瓶 1 个 3、250ml 三角瓶8 个 4、15×150mm 试管18 支 5、13×130mm 试管30 支 6、1ml 移液管 5 支 7、10ml 移液管 2 支 8、直径为90 mm 平皿12 套 9、250ml 量筒 1 支 二)应灭菌的其它器材 剪刀1 把不锈钢汤匙 三)应准备的培养基和试剂 1. 缓冲蛋白胨水(BP) : 2. 氯化镁孔雀绿(MM)增菌液: 3. 亚硒酸盐胱氨酸(SC) 增菌液: 4. 亚硫酸铋琼脂(BS) :4 皿 5. SS琼脂:6 皿 用途 稀释样品制缓冲蛋白胨水制增菌 液、培养基制三糖铁培养基和 PH7.2 尿素制蛋白胨水等 制BS 、SS平板 1把称量纸适量 培养基总量所用容器 1瓶225ml/瓶500ml 三角瓶1瓶100ml/瓶250ml 三角瓶1瓶100ml/瓶250ml 三角瓶1瓶60ml /瓶250ml 三角瓶1瓶100ml/瓶250ml 三角瓶
沙门氏菌控制措施
沙门氏菌 命名 1885年沙门氏等在霍乱流行时分离到猪霍乱沙门氏菌,故定名为沙门氏菌属。沙门氏菌属有的专对人类致病,有的只对动物致病,也有对人和动物都致病。沙门氏菌病是指由各种类型沙门氏菌所引起的对人类、家畜以及野生禽兽不同形式的总称。感染沙门氏菌的人或带菌者的粪便污染食品,可使人发生食物中毒。 形态 菌体大小(0.6~0.9)×(1~3)微米无芽胞,一般无荚膜,除鸡白痢沙门氏菌和鸡伤寒沙门氏菌外,大多有周身鞭毛。营养要求不高,分离培养常采用肠道选择鉴别培养基。 生化反应对本属菌的鉴别具有重要参考意义。不液化明胶,不分解尿素,不产生吲哚,不发酵乳糖和蔗糖,能发酵葡萄糖、甘露醇、麦芽糖和卫芽糖,大多产酸产气,少数只产酸不产气。VP试验阴性,有赖氨酸脱羧酶。DNA的G+C含量为50~53%。对热抵抗力不强,在60℃15分钟可被杀死。在水中存活2~3周。在5%的石炭酸中,5分钟死亡。 沙门氏菌属也是嗜温性细菌,在中等温度,中性pH,低盐和高水活度条件下生长最佳。生长最低水活度为0.94。兼性厌氧,对中等加热敏感。同样,该菌属能适应酸性环境。
分类 本属菌按生化反应分为4个亚属。亚属Ⅰ是生化反应典型的和最常见的沙门氏菌;亚属Ⅱ和Ⅳ是生化反应不典型的沙门氏菌;亚属Ⅲ是亚利桑那沙门氏菌。 图为鼠伤寒沙门氏菌 造成饲料中沙门氏菌污染的主要原因是: (1)饲料原料的污染,特别是含肉的原料; (2)饲料在加工过程中由设备和环境带来的污染; (3)原料及成品在储存过程中受到污染; (4)饲料在运输过程中受到污染; (5)包装材料的卫生状况差,带来的污染; (6)成品的保管不规范,引起的污染。 控制措施及控制标准 GB13078—2001饲料卫生标准规定,饲料及原料中沙门氏菌不得检出。对控制饲料
沙门氏菌属食物中毒
沙门氏菌属食物中毒 (一)病原 沙门氏菌属食物中毒一般多由鼠伤寒沙门氏菌、肠炎沙门氏菌和猪霍乱沙门氏菌等所引起。沙门氏菌在20~30℃条件下迅速繁殖。在水中可生存2~3周,粪便中生存1~2个月,在冰冻土壤可过冬。 (二)流行病学 沙门氏菌性食物中毒中最常见的致病菌,在我国占食物中毒的第一位。猪、牛、羊等健康家畜、家禽和蛋类的带菌率较高,有宰前感染,也有宰后污染。某省10年统计资料:猪的生前感染沙门氏菌是比较严重的,其检出率高达26.5%。由于带菌率高、在屠宰加工过程中,往往可造成猪肉污染,猪肉的沙门氏菌检出率为12.5%。肉类食品从畜禽的宰杀到烹调加工的各个环节中,都可受到污染。烹调后的熟肉,如果再次受到污染,并且在较高的温度下存入,食前又不再加热,则更为危险。 沙门氏菌食物中毒,主要发生的夏秋季节外,全年都可发生引起中毒的食物主要为肉类、禽类、蛋类和奶类,豆制品和糕点有时也发生。 (三)发病机理 沙门氏菌随同食物进入消化道后,摄入量在10万以上的才出现临床症状;如果摄入菌量较少,即成为无症状带菌者。但对儿童、老人和体弱者较少量的细菌也能出现临床症状。此外,和不同沙门氏菌致病力强弱有一定的差异。沙门氏菌在小肠和结肠中繁殖,然后附着于粘膜上皮细胞并侵入粘膜下组织,使肠粘膜出现炎症,抑制水和电解质的吸收。 (四)临床表现 沙门氏菌属食物中毒的临床表现有5种类型。 1.胃肠炎型:前驱症状有头痛、头晕、恶心、腹痛、寒战。以后出现呕吐、腹泻、发热。大便为黄色或黄绿色、带粘液和血。因呕吐、腹泻大量失水,一般急救处理是补充水份和电解质。对重症、发热和有并发症患者,可用抗菌素治疗。一般3~5天可恢复,病死率在1%左右。主要是儿童和老人或体弱者治疗不及时所致。 2.类霍乱型:起病急、高热、呕吐、腹泻次数较多,且有严重失水现象。 3.类伤寒型:胃肠炎症状较轻。但有高热并出现玫瑰疹。 4.类感冒型:头晕、头痛、发热、全身酸痛、关节痛、咽峡炎、腹痛、腹泻等。 5.败血症型:寒战、高热持续1~2周,并发各种炎症、肺炎、脑膜炎、心内膜炎、肾盂肾炎。败血症型主要由霍乱沙门氏菌引起。 (五)预防措施 1.防止污染和食物中毒。
沙门氏菌检验方法
沙门氏菌检验方法 关于GB 4789.04-2010 食品安全国家标准食品微生物学检验沙门氏菌检验解决方案 GB 4789.04-2010 沙门氏菌检验流程图 环凯针对标准的修改,扩充完善了微生物检测试剂,推出了成套的沙门氏菌检验解决方案,为生产企业提供方便。 功能阶段实验 序号 产品编号产品名称规格类别 前增菌1023130缓冲蛋白胨水(B PW)250g瓶(干粉)
CP0680缓冲蛋白胨水(B PW)225 mL×10袋盒(袋装)CP0290缓冲蛋白胨水(B PW)225 mL×6瓶盒(瓶装)CP0560A缓冲蛋白胨水(B PW)9 ml×20支盒(管装) 选择性增菌2 023030四硫磺酸钠煌绿增菌液基础(TTB)250g瓶(干粉)SR0040 四硫磺酸钠煌绿增菌液配套试剂 (碘液、煌绿各一支添加于100ml培养基) 2×5支/盒盒(西林瓶)CP0300四硫磺酸钠煌绿增菌液(TTB)10 ml×20支盒(管装)3 023040亚硒酸盐胱氨酸增菌液(SC)250g瓶(干粉)CP0050亚硒酸盐胱氨酸增菌液(SC)10 ml×20支盒(管装) 选择性分离4023050亚硫酸铋琼脂(BS)(配送指示剂)250g瓶(干粉)5 023070HE琼脂培养基250g瓶(干粉)CP0110HE琼脂培养基90mm×20盒(平板) 6 029999木糖-赖氨酸-去氧胆酸盐琼脂(XLD)250g瓶(干粉)029999P木糖-赖氨酸-去氧胆酸盐琼脂(XLD) 300 mL/袋 ×10袋 盒(袋装) 颗粒培养基CP0180木糖-赖氨酸-去氧胆酸盐琼脂(XLD)90mm×20盒(平板)7 CRM004沙门氏菌显色培养基1000 mL瓶(干粉)CP0560A沙门氏菌显色培养基平板90mm×20盒(平板)8HM42沙门氏菌乳胶凝集试剂盒50 tests套 生理生化 9 022080三糖铁琼脂(TSI)250g瓶(干粉)CP0080三糖铁斜面20支盒(管装)075750三糖铁20支盒(西林瓶) 10 022110蛋白胨水 (靛基质培养基,色氨酸肉汤)100g瓶(干粉)075240蛋白胨水 (靛基质培养基,色氨酸肉汤)20支盒(西林瓶)029230靛基质试剂10 mL×1支盒 11 023090尿素琼脂培养基基础100g瓶(干粉)02910040%无菌尿素溶液 2 mL×10支盒(西林瓶)075150尿素琼脂培养基20支盒(西林瓶)12 075330氰化钾生长实验管20支盒(西林瓶)075340氰化钾对照管20支盒(西林瓶)13 075280赖氨酸脱羧酶培养基20支盒(西林瓶)075290氨基酸脱羧酶对照培养基20支盒(西林瓶)029110无菌石蜡油10 mL×1支瓶14075090山梨醇20支盒(西林瓶)15075040甘露醇20支盒(西林瓶)16075180β-半乳糖苷 ONPG20支盒(西林瓶)17071740沙门氏菌生化鉴定试剂盒10种×10支盒(西林瓶)18075100卫矛醇20支盒(西林瓶)19075140水杨素20支盒(西林瓶)20075190丙二酸盐20支盒(西林瓶)
沙门氏菌
禽沙门氏菌病(PullorumDisease)是由沙门氏菌属中任何一个或多个成员所引起的起鸡类的一种急性或慢性疾病。该病除水平转播外,主要通过卵转递,是贯穿整个养鸡周期的一种恶性循环式的疾病。该病能使鸡的受精率和孵化率及产蛋率下降,对养鸡业造成重大危害。患病雏鸡以白痢为特征,雏鸡常常表现急性败血症状。成年鸡或呈急性经过,或呈慢性隐性感染。在某些逆境因素应激作用下,育成鸡也可爆发急性感染,并且死亡率较高。 1 历史起源 1885年Salmon于猪霍乱病流行是分离到猪霍乱杆菌。1888年Gartner从急性胃肠炎者分离到肠炎杆菌,到1900年为纪念猪霍乱杆菌的发现者美国细菌学家Salmon,将此类细菌命名为Salmonella(沙门氏菌)。目前已发现的沙门氏菌至少有67种抗原和2100多个血清且不断有新的血清发现。我国迄今发现有201个血清型,在国际公认的沙门氏菌表中有三个血清型以中国地名命名,分别是上海沙门氏菌(S.Shanghai)、自贡沙门氏菌(S.Zigong)和广州沙门氏菌 (S.Guangzhou)最初都以沙门氏菌所致的疾病来命名,如雏鸡白痢、猪霍乱。后来发现很多沙门氏菌并单纯引起某种动物的特殊疾病,于是改用以其最初分离的地名来命名,如伦敦沙门氏菌(S.London)、都柏林沙门氏菌病(S.Dublin)等。后来,由于地名越来越多,令人难以记忆而以抗原式来命名了。伴随着养禽业的飞速发展,加上有大量的易感的动物,因而几乎全世界所有的养鸡地区都发现了本病的存在。 禽白痢(PullorumDisease)是由禽沙门氏菌(SalmonellaPullorum)引起的家禽传染病。1899年,Rettger发现了本病的病原,并将该病描述为“雏鸡致死性败血症”称本病为“细菌性白痢”,在1900~1910年间许多研究者已经确定本病为一种卵性传染病。1913年康乃尔大学的Jones发明了一种肉眼可观的试管凝集实验来检出本病的带菌者。1928年有人将细菌性白痢更名为雏鸡白痢病,并且从此得到了普遍的承认。1931年Schsffer等发明了一种改良的全血凝集实验,这种实验应用的是抗原,由于方法简单,特异性强取代了一种改良全血凝集实验,这种实验应用全血平板凝集实验在鸡群中检出鸡白痢带菌鸡,并从鸡群中淘汰出去,从而使该病在鸡群中的发病率有较大幅度的下降。 2 病源学 自1885年Salmon发现沙门氏菌以来已有百年的历史,许多学者对沙门氏菌的生物学特性进行了广泛的研究,认为沙门氏菌是一群革兰氏阴性,无芽孢无荚膜的杆菌,除雏鸡白痢沙门氏菌和鸡伤寒沙门氏菌外,其余都有鞭毛,能运动。大多数沙门氏菌具有菌毛,能吸附于细胞表面;能发酵葡萄糖,麦芽糖,甘露醇产酸产气,不发酵乳糖,蔗糖,不产生吲哚,不分解尿素,不液化明胶,MR实验阴性,V-P实验阴性。沙门氏菌具有稳定的菌体抗原和鞭毛抗原,少数沙门氏菌还有表面抗原(Vi抗原)。根据沙门氏菌具有不同的O抗原和H抗原。将本菌分成很多血清型。1941年Younie首次发现了禽白痢沙门氏菌抗原型的变异。Kauffman-Whiter认为抗原型的变异发生在O12-2和O12-3上。在标准菌株中含有大量的O12-3,而含有少量的O12-2,在变异菌株中含有大量的O12-2,而只含有少量的O12-3,中间型菌株介于两者之间。早期进行有关鸡白痢沙门氏菌抗原变异型的调查表明,在美国的一些地区的分离物中三分之一为变异型,到1950年变异型仅占总分离物的13%。 众所周知,禽沙门氏菌病在世界各地均有发生,但在不同国家和地区所分离到的沙门氏菌血清型,常有其该国家的特征性。Sojka对英格兰和威尔士的
一起由沙门氏菌引起的食物中毒调查分析
一起由沙门氏菌引起的食物中毒调查分析 发表时间:2012-12-10T13:23:02.560Z 来源:《中外健康文摘》2012年第34期供稿作者:朱艳梅汤艳[导读] 根据现场流行病学、卫生学调查和实验室检验结果分析,是一起沙门氏菌引起的细菌性食物中毒。 朱艳梅汤艳(孝南区疾病预防控制中心 432000)【中图分类号】R155.3+2 【文献标识码】A【文章编号】1672-5085(2012)34-0080-02 2011年7月6日20时,接辖区一卫生院电话报告,该镇王某在家为其母举办寿宴,宴后16人出现呕吐、腹泻等症状,已在送市人民医院途中。根据现场流行病学、卫生学调查和实验室检验结果分析,是一起沙门氏菌引起的细菌性食物中毒。现将调查情况报告分析如下。 1 材料与方法 1.1 调查对象 根据丧宴举办方提供的就餐者名单,对每位就餐者、厨师及服务人员开展流行病学调查;采集病例肛拭或粪便等标本16份;厨师及服务人员肛拭或粪便标本5份;采集剩余食物标本6份(蛋糕、蹄花、丸子、鳜鱼、合菜、板鸭);宴席用调料、加工用具9份。 1.2 样本检测 所有标本按照GB4789、WS/T-1996、霍乱防治手册(第五版)等病原菌检测方法进行检测,所有检测试剂均在有效期内使用。 2 结果 2.1 流行病学调查 2.1.1 基本情况。2011年7月5~6日在王某在家为其母亲举办寿宴,就餐客人主要是乡村和亲朋好友,参加人员290人,分别于5日18时和6日12时两餐,所有食物均由临时聘请厨师管某某等3名餐饮服务人员进行加工。主要食物在孝感市某集贸市场采购,鳜鱼由王某某于两天前从武汉带回。从7月5日晚23时起进餐者中陆续有人出现腹胃道症状,截止7月6日下午,共有16人出现腹泻、腹痛等症状,病例在市人民医院经过治疗后,症状迅速缓解或消失,于7月7日全部出院。 2.1.2 发病时间分布。16例患者中,首发病例发病时间为7月5月晚23时,末例为6日晚19时,6日上午发病4例,中午发病3例,下午发病8例。 2.1.3 年龄和性别分布。16例患者中,发病年龄最大的62岁,最小的12岁,各年龄组均有发病,男女发病比1:2.2。2.2 2.2临床表现 患者症情轻重不一,但症状基本相同,主要表现为腹痛、腹泻、恶心、呕吐等症状,其中腹痛症状100%、腹泻症状100%(黄色水样便)、恶心呕吐症状18.75%,发热症状6.25%。经治疗后症状迅速缓解或消失,病程1~2天。 2.3 实验室检验 实验室共采集各类样品35份,其中患者和厨师大便或肛拭子样21份、剩余食品样6份、餐饮用具和调料样9份。均未检出霍乱、志贺氏菌、致病性大肠、变形杆菌、金黄色葡萄球菌。因采集标本时病例多已用药,仅从1名腹泻患者肛拭标本和剩余鳜鱼中分离出沙门氏菌,分离菌株在SS平板色半透明中心黑色菌落,涂片染色呈革兰氏阴性短小杆菌,挑取上述菌落转种TSI,不分解乳糖,分解葡萄糖产酸,产少量气,H2S阳性,纯培养后制成菌悬液接种API20E生化条,API编码均为:6704552,鉴定结果为沙门氏菌;分离菌株与沙门菌A-F多价诊断血清,盐水对照均为阴性。根据菌落形态、生化试验和血清学鉴定,可判断分离菌株均为沙门氏菌。 2.4 病因分析 16名患者均于7月5日参加了王某为其母亲举办的寿宴,并于7月5日晚起陆续发病,感染率为5.93%,调查就餐者的密切接触者未发生感染,从患者和食物标本中同时分离到沙门氏菌,由此可推断是由于举办寿宴食物受到沙门氏菌引起的食物中毒事件。 2.5 卫生学调查 事主王某家宴席在一临时院落举办,环境卫生差,卫生设施简陋,无“三防”设施,主厨和帮工共5人,均未取得健康证和卫生知识合格证。食物加工方法是蒸、炸、凉拌。许多食物(包括凉菜)是在7月5日晚将调料配好后放置,均未进行冷藏。生熟食品加工过程未严格分开。 3 讨论 3.1 农村家宴现状及存在的问题 随着社会经济的发展,农村举办家宴的名目特别繁多,传统的婚丧嫁寿娶等都是举办宴席请客的时机。频繁的农村家宴也使食物中毒的机率大增,给食品安全埋下隐患,主要存在以下问题: 3.1.1 加工场所条件简陋,卫生设施无法达到法定的基本卫生要求,一般都是临时加工点,多数农家厨房仅能供自家一日三餐加工烹调食物,缺乏必要的冷藏、清洗、宰割等加工用具和卫生防护设备,宴席制作常常是垒土为灶,拆门为案,露天为厨。 3.1.2 加工地点流动性大,参加人数多,举办时间长。一般都是在户主自己家里举办,食品加工的地点随意性大,生熟食品未分开,参与食品加工的人数多。农村一般都是好面子,重情轻礼,讲究人到情到,往往是全家参加,宴席少则几十桌,多则上百桌,举办时间少则一天,多则达到二、三天。 3.1.3 农村厨师文化低,没有经过食品安全知识、法律法规等相关知识的培训,没有进行健康体检,基本上没有“健康合格证”。 3.1.4 饮水卫生问题。农村的饮水多数是井水,没有自来水,井水平时供应家庭3-5人日常用量尚可,当突然增加几百人饮用,饮水的量就不够,只有从附近的堰塘、山沟或水田去取水用,这些用水均存在不同程度污染,在采用生活用水也没有进行有效的消毒。 3.1.5 家宴管理无法可依。家庭宴席承办人无法成为有关部门的管理相对人,迄今为止,我国尚无一部专门针对家宴管理的法律法规,属于食品安全监管的“盲区”。 3.2 对策 3.2.1 健全制度,落实责任。在国家尚无相关法律约束的情况下,要因地制宜,在尊重当地风俗习惯的基础上,制定出相应的便于操作,群众易于接受,切实可行的安全措施,农村家宴问题应更多在行政和民俗层面上共同解决,将农村家宴的安全管理工作纳入乡村政府组织的行政管理范围。
相关文档
- 食品中沙门氏菌的污染及预防
- 沙门氏菌检验方法(pdf 52页)
- 生活中的沙门氏菌,金葡菌食物中毒标准规定样式分析
- 沙门氏菌食物中毒案例浅析
- 沙门氏菌
- 沙门氏菌对食品的污染及其导致的食源性疾病
- 生活中的沙门氏菌、金葡菌食物中毒案例分析报告
- 沙门氏菌
- 沙门氏菌的检验分析
- 食品中沙门氏菌的污染及预防
- 沙门氏菌属食物中毒及预防
- 国家食品沙门氏菌检测(内含简图很有用)
- 沙门氏菌食物中毒
- 预防沙门氏菌食物中毒
- 沙门氏菌基本知识及检测方法
- 食品中沙门氏菌检验操作规范(已完)
- 沙门氏菌属食物中毒
- 浅谈沙门氏菌研究
- 沙门氏菌食物中毒案例浅析
- 生活中的沙门氏菌、金葡菌食物中毒案例分析PPT课件
