质量监督操作标准SOP-QA
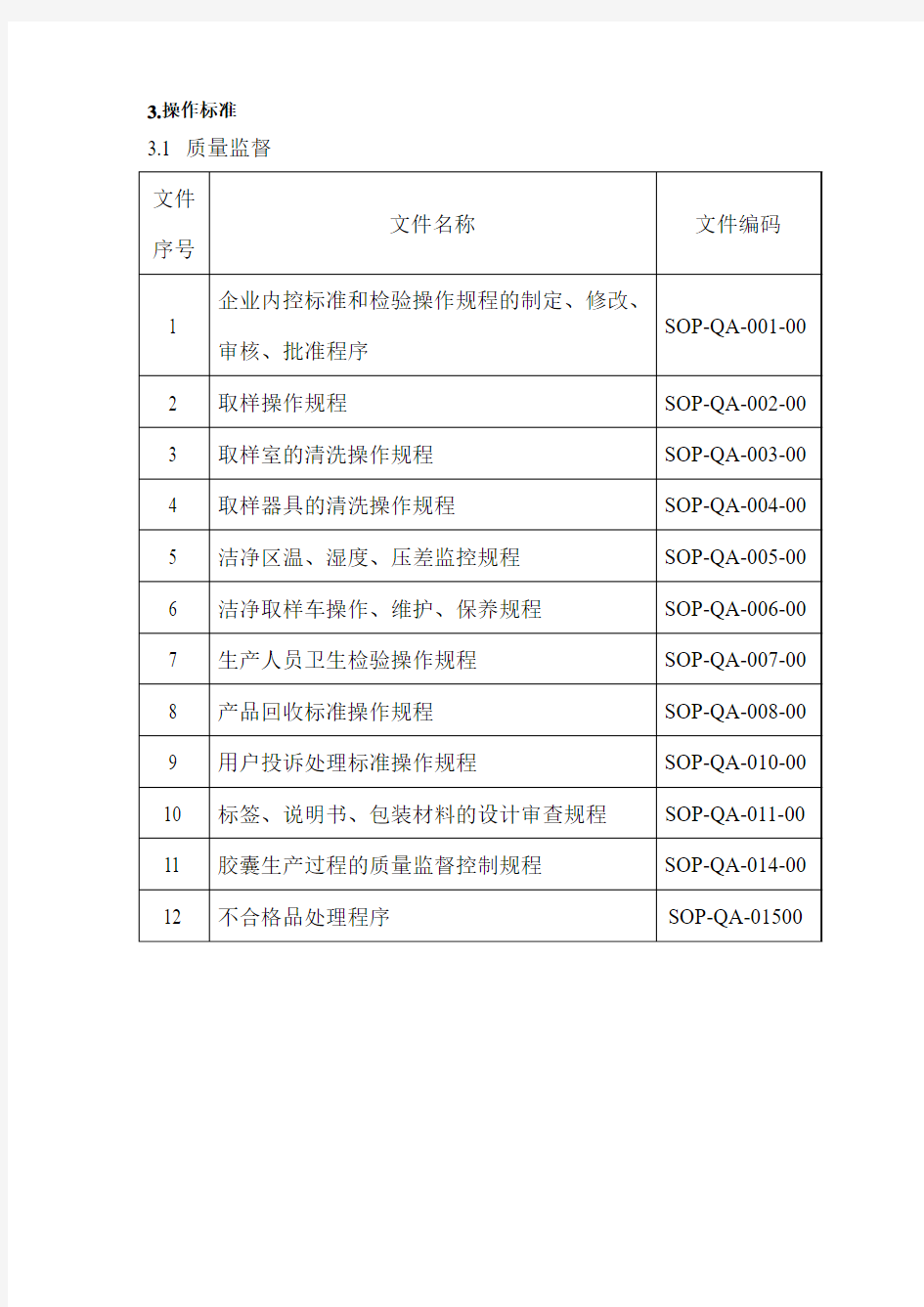

3.操作标准3.1 质量监督
目的:为了确保药品质量,使公司生产的药品在法定标准的基础上进一步提高,特制定企业内控标准和检验操作规程的制定、修改、审
核、批准规程。
范围:成品、中间产品、物料的内控标准和检验操作规程。
责任人:质管部、生产部、供销部。
内容:
1、内控标准和检验操作规程由质管部门负责制定,制定的依据是法定标准及近两年来产品的质量情况统计分析表,并在此基础上有一定提高。
2、质管部门将制定的内控标准和检验操作规程草案会同生产部的技术人员进行讨论,提出修改意见,形成共同认可的公司内控标准和检验操作规程初步方案。
3、将已经过质管、技术、生产部门讨论修改过的内控标准方案交质管部部长审核,总经理批准, 检验操作规程初步方案由QA填写《检验方法变更情况表》(REC-QA-029-00)经质管部部长批准。
4、由质管部负责将批准生效的内控标准和检验操作规程以文件的形式发到公司有关部门,并规定新文件执行日期即旧文件作废日期。
目的:建立原料、辅料、包装材料、中间产品及成品的取样程序。
范围:适用于公司的所有原料、辅料、包装材料、中间产品及成品的取样。
责任人:QA检查员、仓库管理员、生产部相关人员
内容:
1、取样人员:QA(水质采样由QC除外)
2、取样地点:直接入药的原辅料及直接接触药品的包装材料和聚乙烯袋的取样在仓库洁净取样车中进行;非直接接触药品的包装材料的取样在仓库待验区中进行;中间产品的取样在车间洁净区中进行;成品取样在车间外包工序包装封箱前进行。
3、取样工具和盛样器具。
3.1在洁净取样车和车间洁净区内的取样工具和盛样器具的卫生要求:直接接触药品的取样工具和盛样器具均不得与药品发生化学作用, 微生物限度检查用样品的取样工具和盛样器具须经灭菌处理,使用前必须严格按《取样器具的清洗操作规程》(SOP-QA-004-00)洗净消毒,并且在有效期内。直接接触药品的取样工具在使用后,及时洗净,并按《取样器具的清洗操作规程》(SOP-QA-004-00)洗净消毒,放入无毒塑料袋包好,并贮存于仓库洁净取样车内备用。
3.2取样工具:
3.2.1液体原料取样工具为空心玻璃管,粉体、颗粒(如二氧化硅和空心胶囊、中间品等)的取样工具为取样勺,片材(如PVC硬片、PTP铝箔)的取样工具为手术剪刀;以上取样样工具在使用前必须严格按《取样器具的清洗操作规程》(SOP-QA-004-00)洗净消毒,并且在有效期内。3.2.2包装材料和成品直接手工取样。
3.3盛样器具:液体原料的盛样器具为可密封的玻璃瓶,其余物料盛样器具为无毒塑料袋盛样;成品为原包装产品。
4、取样包装件数:
4.1原辅料、包装材料、成品:一般总件数当n≤3时,每件取样;n为4—300,取样数为n +1;当n>300 时,取样数为 n /2+1。
4.2中间产品均匀取样。
4.3取样数量和取样份数:按附表规定量进行,取样后交QC。
一次取样的样品量最少为检验量的三倍量(包装材料除外);成品稳定性试验每批取样32盒,原料稳定性试验每批取样400克。
5、物料进出仓库洁净取样车操作程序
5.1先开取样车,开紫外灯灭菌三十分钟和净化空气吹三十分钟。
5.2清理待检品包装外部,清理后移入洁净取样车内,如有外包装去掉外包装。
5.3用乙醇棉球擦拭待检品开口周围,晾干后开始取样。
5.4物料取样后,用已灭菌的线扎紧内包口(塑料桶旋紧桶盖),移出洁
净取样车后,如有外袋用封口机封口,并立即贴上《取样证》(REC-QA-001-00)。
5.5取出的样品放入盛样器具内,取出样品混匀后,按要求份数分装,如是玻璃瓶立即盖紧;如是无毒塑料袋立即用已灭菌的线扎紧,装入外袋内,移出洁净取样车后,用封口机封口,并立即贴上《取样证》(REC-QA-001-00)。
5.6多件取样按5.2至5.5条重复进行。但每件物料的取样工具需更换,避免造成交叉污染。
6、取样人员进入仓库洁净取样车操作程序
6.1关闭紫外灯。
6.2取样人员操作前必须先用肥皂洗手,并用酒精棉球擦手。
6.3手伸进洁净取样车。
6.4净化空气吹5分钟后戴上洁净手套。
6.5用已灭菌的手术剪刀将待检品启封。开始工作。
6.6在物料移出洁净取样车前,应脱下洁净手套,放入装洁净手套的洁净袋中。
6.7多件取样时,先用酒精棉球擦手,然后按6.3至6.6条重复进行。6.8取样完毕后,清理现场,并按《取样车的清洁操作规程》(SOP-QA-003-00)进行。
7、取样记录:
7.1取样后需称重,并及时填写取样记录,成品、中间产品取样填写《产
品取样记录》(REC-QA-039-00),原料、辅料、包装材料取样填写《原料、辅料、包装材料取样记录台帐》(REC-QA-031-00),内容有取样日期、品名、代号或编号、规格、批号、数量、来源、包装、取样件数、必要时说明、取样人签名等。
8.特殊要求:
8.1原辅料发放时,发现有疑问,应重新取样复验;
8.2超过规定贮存期的原辅料,应重新取样复验,合格后方可发放;8.3每份样品应有标签《取样证》(REC-QA-001-00),标明品名、批号、代号或编号、取样日期、取样人等,连同《请验证》取样后交QC。
8.4取样后,应及时在取样车内对取样的包装进行封口,有外包装的包上外包装;并贴上《取样证》(REC-QA-001-00)以表明该包装已取样。
目的:建立取样车清洁操作规程,确保取样样品不受污染。
范围:适用于本公司取样车的清洁
责任人:QA检查员、仓库管理员
内容:
1.清洁频度:
1.1每次取样后清洁一次。
1.2半个月彻底清洁一次,清洁时必须按本规程进行。
2.清洁工具:拖把、水桶、清洁布。
3.清洁剂:洗涤剂。
4.消毒剂:75%乙醇溶液、3%甲酚皂溶液、0.1%新洁尔灭溶液。5.清洁方法:
5.1清除取样车的取样遗留物及废弃物。
5.2洁净抹布擦干取样车的内壁、顶部、台面至无上次物料的。
5.3洁净取样车内的容器具按《30万级洁净区容器、器具清洁消毒规程》(SOP-WS-012-00)。
5.4用洁净抹布、清除,有污迹、污垢用清洁剂擦洗清除,必要时用消毒剂消毒。
5.5每半个月取样车内外用消毒剂彻底清洁消毒一次。
目的:建立取样器具的清洗方法,规范取样器具清洗的程序
范围:适用于公司所有取样器具的清洗
责任人:质量管理部QA质检员
内容:
1、清洗取样器皿、器具时,先用饮用水冲洗数次,再用适宜的毛刷沾洗涤液(肥皂水或洗衣粉水溶液等)反复刷洗,再用饮用水冲洗至无泡沫,最后用纯化水冲洗三遍。
2、清洗后的器具应不挂水珠。
3、洗涤后的取样器具先在105℃条件下烘干,再包扎好放在180℃电烘箱中烘干二小时。
4、用于微生物检查取样的取样器具:
先执行前述1、2、3条程序,干燥后的器具包好密封存放在洁净取样车内,使用时间不得超过一星期。
5、超过规定存放时间应重新洗涤、干燥或灭菌。
目的:建立洁净区温度、湿度、压差监控规程,使空调系统能够有效控制洁净区的温度、湿度、压差。
范围:适用于洁净区温度、湿度、压差的监测控制。
职责:QA质监员、工程部维修人员、生产部人员。
内容:
1.标准
1.1温度:空调系统在规定的运行期间和装有加热器的情况下,在全年温度变化的情况下,应能够将洁净车间温度维持在18-26℃。
1.2相对湿度:冷冻干燥工序、粉碎过筛工序、总混工序、充填抛光工序控制在30%以内,其他控制在45-65%。
1.1.3压差:不同洁净级别之间的静压差应≥5Pa(0.5mm水柱),洁净区与非洁净区之间的静压差应≥10Pa(1.0㎜水柱)。静态或动态情况下,压差均应能始终维持设计规定的数值。
2.监测仪器:经计量检定过温度计、湿度计、微压表。
3.测试方法:测试空气平衡结束后进行,随时观察温度、湿度、压差变化情况,及时填写《洁净区压差、温湿度检测记录》(REC-QA-019-00)。4.监测频率:每班检测不少于一次。
5.注意事项:
5.1 测试时所有的空调系统和层流系统应处于连续的运行状态。
5.2为避免压力出现不必要的变化,测试状态应固定,并应从平面上最里面的房间依次向外测定。
5.3洁净区所有的门应关闭,测试时不允许有人穿越房间。
6.在洁净车间温度、相对湿度和压差的监测过程中,如发现结果超出规定的范围,应及时通知工程部维修人员和生产车间检查原因并改正。
2.洁净车间温度、相对湿度和压差的检测及根据检测结果对空调系统进行的调整应记录归档。
目的:建立洁净取样车操作、维护、保养规程
范围:适用于洁净取样车操作、维护、保养
责任人:QA人员、工程部HVAC系统操作人员。
内容:
1.工作原理
洁净采样车(以下简称该设备),是一种垂直层流的局部空气净化设备。室内空气经过预过滤器,由小型离心风机压入静压箱,再经过高效过滤器二级过滤,从高效过滤器出风面吹出的洁净气流具有一定大小和均匀的风速,可以排除工作区域原来的空气,将尘埃颗粒和生物颗粒带走,以形成高洁净度的工作区域。
2.结构特点
该设备采用整体结构,自上而下垂直送风,箱体用优质薄钢板折弯、焊接而成。箱体内装有预过滤器、高效过滤器、低噪音可变速离心风机及电器元件。支撑部分左、右面镶有玻璃,前、后面装有装饰帘子;本设备通过调节风机的输入电压,改变其送风量,使出风面的平均风速始终保持在合适的范围内。
3.主要技术参数
3.1工作环境温度: 5 ~ 40℃
相对湿度:≤80%
大气压:86 ~ 106pa
3.2净化级别:10万级
即≤350000颗/M3(≥0.5μm尘埃)
注:应在离地面80 ~ 100cm处测定
3.3平均风速: 0.3m/s ± 20% (可调)
3.4噪声:≤ 63 dB (A)
3.5振动:≤ 3μm (X、Y、Z方向)
3.6照明:≥ 300 Lx
3.7电源: 220V ± 10% 50Hz ± 1Hz
3.8最大功耗: 400 W
4.操作
4.1通电前先将设备内外擦拭干净,检查四只脚轮是否均着地。否则,请首先调整或垫平四只脚轮。
4.2定期(比如两个月)用“风速仪”测试工作区域的平均风速。用“尘埃粒子计数器”检测工作区的洁净度。若发现上述两项有不符合技术要求者,应调节风机电压,使设备处于最佳状态。
4.3接通电源,揿下风机按钮,仪器即开始正常工作。按下紫外线灯控制开关,可同时进行操作区面的灭菌。
4.4依次将经灭菌的取样器具、待取样的原材料放进工作区,打开包装,经30分钟后(无菌风吹淋),才可开始取样。
4.5取样完毕,彻底清理后再关机。
4.6工作区及其周围严禁有明火。
4.7该设备应放置在通风干燥的库房内,不得随便移动。
5.维护、保养。
5.1根据使用环境的洁净程度,定期将预过滤器中的滤料拆下清洗,间隔时间一般为3个月为宜。
5.2当风机电压调至最大,工作区风速仍然达不到技术要求时,则必须更换高效空气过滤器。
5.3更换高效空气过滤器后,应该用“尘埃粒子计数器”检测过滤器周边密封是否良好。然后,调节风机输入电压,使工作区的平均风速达到技术要求,再用“尘埃粒子计数器”检测工作区的洁净度。
5.4更换高效空气过滤器时,应注意过滤器上的箭头标志,箭头指向即为气流方向。
5.5维护、保养工作由工程部HVAC系统操作人员操作,过滤器的维护、保养具体按《空气净化系统清洁、维护、保养规程》(SOP-CF-003-00)操作。
目的:建立生产人员卫生检验操作规程,使QA生产人员的卫生检查更具操作性,同时保证操作人员保证良好的卫生。
范围:适用于对本公司生产人员的卫生检查。
责任人:QA质监员、生产部相关人员
内容:
1.个人卫生:健康,无急、慢性传染病;保持个人清洁卫生,头发整洁,胡子刮的干净,进入生产区现场应的人员穿戴整齐、干净、完好符合工作要求的工作服、帽子、口罩、鞋等,进出洁净区严格执行人员净化与进出程序。
2.生产操作人员不得化妆和佩带饰物,并不得裸手直接接触药品;不准穿戴工作服、帽子、口罩、鞋等离开生产区域。
3.工作服要求质地光滑不掉纤维、不脱落断丝,不产生静电,不粘附粒子等;洁净工作服应线条简单,不设口袋,宽松合身。
目的:建立产品回收的工作规程,保证存在质量问题可能危及或伤害用户健康的产品能及时回收。
范围:适用于本公司售出的产品回收。
责任人:质量管理部部长、质量管理部QA、供销部部长、销售人员、财务部及相关部门的协助人员。
内容:
1.发现或有证据表明市场销售的产品存在质量问题时,应迅速采取措施回收。
2.产品回收工作由质管部通知供销部,由供销部部长负责产品回收决定的实施工作。
3.根据销售产品的具体情况及回收时限要求,分为一般情况产品回收和紧急情况产品回收。
4.一般情况产品回收:
4.1 公司发现市场销售的产品存在一般质量问题(不会危及用户健康,如通过留样考察发现质量问题或者其它途径发现),由质管部填写《一般情况产品回收拟处理单》(REC-QA-038-00),并提供该产品品名、规格、批号、总数量、库存量、该产品及相邻两批产品的销售日期、用户单位(名称、库存量、地址、电话、联系人、用户对该产品的销售去向调查)。报经公司总经理审批。
4.2质量管理部部长接到公司总经理同意的《一般情况产品回收拟处理单》(REC-QA-038-00)后,立即组织回收工作,根据供销部提供的该批次的销售记录制订书面回收计划,内容包括:收回产品名称、规格、被收回单位名称、数量、地址、电话、联系人、收回方式、收回时限、收回原因填写《回收通知单》(REC-QA-023-00),通知供销部及相关人员立即执行,收回时限一般在半月左右。
4.3供销部要定期向质量管理部负责人报告回收进出情况和异常情况,以便随时进行协调处理。
4. 4回收的产品存放于待验库,并挂上待验状态标志。回收的产品处理执行《退回产品处理程序》(SOP-XS-002-00)。
4.5产品收回的各个阶段要由参与人员作好记录,包括所采取的措施、日期、时间等。整理签名后交质量管理部负责归档。并保存至三年或产品有效期后一年。
5.紧急情况产品回收
5.1公司销售的产品存在严重的质量问题或不良反应可能危及或伤害用户健康时,必须立即执行紧急情况产品回收程序。
5.2公司销售的产品存在严重的质量问题或不良反应可能危及或伤害用户健康时,质管部QA 立即通知质管部部长反映给公司总经理,请求立即执行紧急情况产品回收程序。
5.3公司总经理做出紧急情况产品回收决定后,公司应立即成立由质量管理部部长、办公室主任、生产部部长、财务部部长、供销部部
长等人员组成的领导小组,负责紧急回收全过程的领导决策和异常情况处理;并成立工作小组,负责实施产品紧急回收工作。
5.4 决定下达后,24小时内工作小组要准备好如下资料:
5.4.1 产品品名、规格、批号、总数量、库存量、该产品及相邻两批产品的批生产记录、相关的检验报告单、复检的检验记录及报告单或不良反应调查表。
5.4.2 产品批销售记录:该产品及相邻两批产品的销售日期、用户单位(名称、库存量、地址、电话、联系人、用户对该产品的销售去向调查)。5.4.3 产品停止使用说明或销售说明。
5.4.3.1紧急回收产品名称、规格、批号、数量、被回收单位名称、地址、电话、联系人、回收方式、回收时限、回收原因并填写《紧急回收药品通知单》(REC-QA-024-00)。
5.4.3.2可能造成的医疗后果,建议采用的补救措施或预防措施。5.4.3.3立即发出停止使用的通知
5.5工作小组应尽快将有关情况通知湖州市药品监督管理局安全监察注册处。
5.6供销部根据工作小组指示迅速通知用户及有关部门,以最快的方法和途径回收产品。
5.7回收过程中供销部应随时向领导小组报告回收进展情况、收回数量、与规定的差额、异常情况处理及请示,不得延误。领导小组要24
小时留有值班人员,密切注视事态发展,随时处理可能发生的情况。
5.8从市场回收的产品存放于不合格库,逐件贴上状态标志,隔离存放,挂上醒目的红色状态标志,专人保管,不得动用。
5.9紧急回收的药品处理由领导小组会议决定,并报公司总经理同意后按决定执行。
5.10 紧急回收的每一阶段,所有参与人员均应将所采取的措施和时间详细记录。回收工作结束后,要整理分析并交紧急回收负责人归档,保存三年或有效期后一年。
5.11领导小组根据回收进展情况决定紧急回收工作是否已基本完成。紧急回收工作完成后,要以书面形式宣布结束,并立即通知有关部门,进入正常管理状态。
10. 产品紧急回收负责人要将此次回收过程以书面总结,归档保存三年或有效期后一年。
目的:建立用户投诉处理标准操作规程。
范围:所有用户的质量投诉.
责任人:质管部部长,质管部QA.
内容:
1.用户投诉的接收:
1.1对于用户质量投诉由质管部QA统一接待,包括信函的开启,来人的接待,来电的解答等.公司其他部门有义务将不同渠道来的质量投诉及时转报质管部。
1.2对每一来函,来人,来电中反映的质量问题应认真做好记录,建立《用户质量投诉登记表》(REC-QA-037-00)。
1.3根据《用户质量投诉登记表》(REC-QA-037-00)提供的情况,进行分类,开展调查,取证及处理工作。
2.用户质量投诉的分类:
2.1外在缺陷:无临床意义的质量问题,如外包装破损,原箱短少等。2.2一般缺陷:从感官即可辨别的质量问题,并不会对用户健康造成伤害,如胶囊变形,变色,结块,,粘结等。
2.3严重缺陷:内在质量问题,存在着危及或伤害用户健康的可能性,如误贴标签,混药等。
质量标准管理规程
【目的】 规范质量标准管理,确保生产过程中所用物料及所得产品符合相应的技术要求,确保产品的质量、安全性、有效性和一致性。 【范围】 适用于公司所有质量标准的管理。 【职责】 1质量控制室 1.1制定和修订原辅料、包装材料、中间产品、成品的质量标准; 1.2质量控制室主管审核质量标准。 2质量保证室 2.1包装材料实样的校对、审核; 2.2质量保证室主管审核质量标准; 2.3监督生产过程中是否按照批准的质量标准进行检验。 3研发部 制定和修订中药材的质量标准。 4质量管理负责人 4.1批准质量标准; 4.2批准包装材料实样。 【内容】 1定义 质量标准:检验项目、检验依据、认可标准(数值限度、范围或所述检验项目的其他标准)的明细资料,它组成了确认物料或产品符合其适用性的标准。“符合质量标准”表示物料或产品按规定的方法检验时,符合所列的接受标准。 2企业质量标准分类 物料企业质量标准、中间产品企业质量标准、成品企业质量标准。 3物料企业质量标准 3.1企业统一指定物料名称、内部使用的物料代码。 3.2质量标准的依据 3.2.1原辅料:依据《中华人民共和国药典》、《中国生物制品主要原辅材料质控标准》、部颁标准、国家标准、行业标准、最终产品企业质量标准、产品工艺要求、供应商提供的企业标准制定。 3.2.2内包装材料:依据《中华人民共和国药典》、国家标准、行业标准、产品工艺要求、供应商提供的企业标准制定。 3.2.3外包装材料:依据国家、地方行政部门批准的标准、行业标准、国家法律法规制定。 3.3应列出供应商,供应商应为已批准的供应商。 3.4包装材料的质量标准应附上印刷包装材料的实样。 3.5质量标准中应包含取样、检验方法或相关操作规程名称或编号。 3.6质量标准中应包含定性和定量的限度要求。 3.7质量标准中应包含贮存条件和注意事项。 3.8质量标准中应包含有效期或复验期。 3.8.1如果有有效期,则制定有效期。 3.8.2如无有效期,则应制定复验期。 4中间产品企业质量标准 4.1中间产品应当有质量标准。 4.2如果中间产品的检验结果用于成品的质量评价,则应当制定与成品质量标准相对应的中间产品质量标准。 4.3中间产品质量标准内容包括: 4.3.1产品名称、代码。 4.3.2质量标准的依据:依据《中华人民共和国药典》、国家标准、部颁标准、最终产品企业质量标准制定。 4.3.3取样、检验方法或相关操作规程名称或编号。 4.3.4定性和定量的限度要求。 第1页共4页
质量管理与标准化综合复习题答案
综合复习题答案 一、选择题 1)最高管理者的职责可以不包括:____。 A.组织内部审核 B.制定质量方针 C.进行管理评审 D.确保获得资源 2)最高管理者承诺通过______方式提供管理承诺证据。 A.制定质量计划 B. 制定产品按收准则 C. 制定质量方针 D. 明确质量职责 3)ISO9001:2008标准规定了_____。 A.质量管理体系术语 B..选用ISO9000族标准的途径 C.质量管理体系要求 d.实施质量管理体系的指南 4)产品实现过程中的预期输出包括:____ _。 A. 顾客要求的产品 B.半成品 C.预期提供给顾客的产品 D. 以上全都是 5)ISO9001:2008标准鼓励在质量管理体系中采用_ ____方法。 A.过程 B.控制 C.统计 D.监督 6)为了产生期望的结果,组织内过程系统的应用,连同这些过程的识别和相互作用,以及对这些过程的管理,可称之为:_____ A.管理的系统方法 B.过程方法 C.基于事实的决策方法 D.系统论 7)表述组织的质量管理体系的文件是______ 。 A.程序 B.质量计划 C.规范 D.质量手册 8)与产品有关的要求包括______。 A. 交货期 B. 明示的要求 C. 隐含的必须履行的要求 D. B+C+A 9)质量管理体系要求______ A.为了使组织的质量管理标准化 B.适用于各种类型、不同规模和提供不同产品的组织 C.是为了使组织的产品质量满足顾客要求 D.为了使组织的产品质量不断提高 10) 质量包括__C___ A.价格 B.维修费用 C.产品的固有特性满足顾客要求的能力 D.A+B+C 11)持续改进质量管理体系的有效性策划是____条款的要求。 A.8.1 B.5.4.2 C.7.1 D. 8.5.1 12)质量策划_____。 A.是质量管理的一部分 B.要求编制质量计划 C.只要求设定质量目标 D.A+C 13)增强满足要求的能力的循环活动是_____。 A.纠正措施 B.预防措施 C.质量改进 D.持续改进 14)质量手册必须包括___ ___ 。 A.质量方针和质量目标 B.质量管理体系的范围 C.各过程的顺序和相互作用 D.B+C 15)交付后的活动包括:______ A.提供担保 B.维修服务 C.产品回收 D.以上都是 16)某组织聘请了两位认证机构的审核员对其供方的质量体系运行进行审核,这种审核是______。 A.第一方审核 B. 第二方审核 C. 第三方审核 D.以上都不是 17)质量目标应______。 A.可测量的 B.都是量化的 C.是能达到的 D.b+c 18)管理评审工作应由______。 A.管理者代表负责领导和组织实施 B.质量经理负责领导和组织实施 C.最高管理者领导进行 D.负有决策职责的董事长领导进行 19)组织实施质量管理体系所需的资源是指______。 A.实施和改进质量管理体系的过程及达到顾客满意方面所需的资源 B.人力资源 C.设施 D.信息 20)针对特定产品、合同或项目的质量管理体系的过程和资源作出规定的文件是______。
实验室检测及质量控制标准操作规程
实验室检测及质量控制标准操作规程 版本号页数页 起草人起草日期年月日审核人审核日期年月日批准人批准日期年月日颁布日期年月日起效日期年月日 威海市立医院 药物临床试验机构
实验室检测及质量控制标准操作规程 一、目的 明确实验室检测质量管理和控制程序,提高实验室整体水平和能力。 二、范围 本院药物临床试验机构及检验科。 三、内容 1.分析前的管理与质量控制 1)临床医生为病人选择合理的的检验项目,正确的采集检验标本; 2)专人查对标本与申请的检验项目、申请单姓名、病区是否相符,标本的质量是否合 格。对不合格的标本拒绝收取,并以电话的方式通知临床,要求重新留取,并作好 登记,记录人签字; 3)保证仪器良好的运转状态,不同的仪器有不同的校准方法。所有进行过的校正和验 证工作都必须记录; 4)每天对试剂的效期、外观、颜色进行观察。建立合理的测试参数,随时观察试剂的 量,及时补充,新旧试剂不得混合在一起使用。 2.分析中的管理与质量控制 1)在采集后小时内分离血清,尽快分析,特殊的检验项目不能尽快检验(或不能当日 检验)要分离血清,低温保存; 2)做质控样本,生化常规检验每批至少测定两个不同水平的质控品,每天分为三批; 3)操作者审核本批次质控结果是否可控,审核临床医生所申请的检验项目是否已全部 检验、有无漏项,检验结果是否填写清楚、正确,判断检验结果无误后签字; 4)上一级医生对检验结果是否正确,报告单填写是否完整等进行审核。审核者签字后 发出报告; 5)所有的检验数据登记备案; 6)对所有的检验项目均应开展室内质量控制,对所有的室内质控原始数据进行记录。 3.分析后的管理和质量控制 1)建立检验报告单发送的签收制度,避免报告单发送错误或丢失; 2)对异常结果、危重病人、疑难患者等检验结果复核或复查; 3)对于直接危及患者的检验结果,如血钾、钙、糖、血气等结果过高过低可能危及患
胡椒质量标准及检验操作规程
XXXXXXXXXXX有限公司原料质量标准及检验操作规程 1 品名: 1.1 中文名:胡椒 1.2 汉语拼音:Hujiao 2 代码: 3 取样文件编号: 4 检验方法文件编号: 5 依据:《中国药典》(2020年版一部)。 6 质量标准:
7 检验操作规程:
7.1 试药与试剂:硫酸、乙醇、胡椒碱对照品、甲苯、乙酸乙酯、丙酮、甲醇。 7.2 仪器与用具:电子天平、水浴锅、紫外光灯、硅胶G板、超声波清洗器、高效液相色谱仪。 7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。 7.4 鉴别: 7.4.1取本品制片置10×10显微镜下做显微观察。 7.4.2取本品粉末少量,加硫酸1滴,显红色,渐变红棕色,后转棕褐色 7.4.3取本品粉末0. 5g,加无水乙醇5ml,超声处理30分钟,滤过,取滤液为供试品溶液。另取胡椒碱对照品,置棕色量瓶中,加无水乙醇制成每lml 含4mg的溶液,作为对照品溶液。照薄层色谱法(附录7)试验,吸取上述两种溶液各2μ1,分别点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-丙酮(7 :2 :1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,加热至斑点显色清晰,分别置日光和紫外光灯(365nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点或荧光斑点 7.5 检查: 7.5.1水分不得过14.0%(附录15 第四法)。 7.5.2二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。 7.6含量测定:照高效液相色谱法(附录8)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-水(77 :23)为流动相;检测波长为343nm。理论板数按胡椒碱峰计算应不低于1500。
质量标准化管理办法(标准版)
质量标准化管理办法(标准版) Safety management refers to ensuring the smooth and effective progress of social and economic activities and production on the premise of ensuring social and personal safety. ( 安全管理) 单位:_______________________ 部门:_______________________ 日期:_______________________ 本文档文字可以自由修改
质量标准化管理办法(标准版) 为了深化质量标准化建设,全面提升我矿安全生产水平,打造一流的安全质量标准化矿井,构建成“五优”矿井和“国家级质量标准化”矿井,确保实现“安全零事故”的目标,根据《义煤集团、大有能源安全质量标准化管理办法》,结合我矿实际,制定本办法。 一、指导思想 坚持以安全发展、科学发展观为统领,牢固树立“安全第一,质量为本”和“一切工作标准化(工程质量标准化、安全管理标准化、行为规范标准化)”的质量标准化管理理念,按照“强基固本、整体推进、严抓细管、提升创新”的工作思路,强化过程
控制,切实加强基层、基础工作和安全质量标准化信息管理,全面开展质量标准化和“五优”矿井建设,夯实安全基础,推进安全质量标准化工作再上新台阶,全面提升我矿质量标准化水平和达标层次,实现我矿质量标准化工作持续、均衡发展,为建设常村长春,实现矿井又好又快发展提供强有力的保障。 二、工作思路 2013年我矿安全质量标准化工作要突出“一个重点”,坚持一个原则,强化“四个意识”,做到“四个并重”,“确保一个实现”。 一个重点:即突出安全质量标准化这一重点; 一个原则:坚持“全面部署、分段实施、重点突破、整体推进”的原则; 四个意识:一是强化各级干部的质量责任意识。二是强化职工的“生命工程”意识。三是强化创新意识。四是强化精品意识。 四个并重:即工程质量标准化与工作质量标准化并重,提升职工质量标准化意识与规范职工行为并重,井下质量标准化与井
工程质量标准化管理
建筑工程质量标准化实施方案 为进一步提高建筑工程质量管理水平,促进全市建筑工程质量管理的科学化、规范化和标准化,借鉴部分开发建设、施工、监理企业标准化管理的成功经验,决定在全市实行建筑工程质量标准化管理。现将有关要求通知如下: 一、搞好前期策划,实行质量预控标准化管理 (一)搞好图纸会审,解决设计缺陷问题 建设单位要切实组织好设计、施工、监理单位进行图纸会审,解决图纸本身的缺陷、节点遗漏和平立剖图纸不符等矛盾,重点核查: 1、是否满足强制性标准的要求,如:栏杆安全高度、安全玻璃使用部位、节能保温防火要求,窗户的选择,以及楼梯、消防楼梯的空间尺寸等。 2、是否影响使用功能,如:空调插座与空调穿墙预留洞位置问题,暖气片与开关、插座间距问题,厨房、卫生间的排烟(气)口的朝向、高度问题,设备管道标高及各种管线标高控制问题等。 (二)进行二次深化设计,解决设计深度和精细化施工问题 工程施工前施工单位要对原图纸进行深化设计,绘制各阶段施工协调综合图纸,解决设计图纸和使用功能需求之间的关系及设计深度不能满足精细化施工要求的问题。 1、在结构施工阶段,应绘制各专业预留预埋管线、箱、盒等综合布置图,协调土建与安装专业预留预埋的关系,做到位置准确,不错不漏,不影响结构安全。 2、在设备安装阶段,应绘制各专业管线安装综合布置图及管线交叉布置节点详图。统筹考虑各管线标高、走向、交叉、支吊架的做法,确定专业交叉部位的安装方法,明确管线布置等。
3、在装饰装修阶段,应绘制各专业末端安装综合布置图。确定各末端设备安装位置,如吊顶上的灯具、烟感探头、消防喷淋、空调风口、音响喇叭等,做到布局合理、居中对称、美观大方,不影响使用功能。 (三)进行图文并茂的技术交底,解决施工操作问题 施工单位必须对每一道工序的班组工人进行技术交底。技术交底的内容,要针对操作工人的特点,深入浅出,通俗易懂,要说明操作的要领、应注意的问题和必须要达到的标准,并对每个节点绘制简图,采用图片结合文字的方式进行交底,做到图文并茂、一目了然,解决施工操作过程中容易出现的质量通病。 二、强化现场管理,实行施工现场质量标准化管理 (一)建立材料设备样品库,封样存放材料设备样品 建设单位应在施工现场建立专用的建筑材料设备样品库,对确认的建筑材料设备样品封样存放,并在每件样品对应部位粘贴展板,说明材料名称、规格、批次、产地、供货单位、使用部位、使用数量、确认意见等,作为大批量材料设备进场验收的依据。封样的主要建筑材料为各种规格的钢筋、墙体砌筑材料、室内外装饰材料、围护系统保温材料、防水材料、铝合金型材、阳台栏杆、电线电缆、配电箱、水暖管材管件、散热器等。对于数量较少、价值较大的设备材料,如高低压柜、变压器、发电机、水泵、电梯等,可不设材料设备样板,按照标准要求进行进场验收。 (二)设置工程样板,分层标识建筑做法,实现可视化管理 施工现场推行"样板领路",重要工序如钢筋绑扎、砌体、顶砖、挂网、线槽及脚手架眼封堵、墙身护角、滴水、内外墙抹灰、室内楼地面、防水构造处理、外墙保温、水电底盒安装定位等应分别做样板后方可大面积施工。 1、设置实物样板
质量检验操作规程
重庆卡顿尔食品有限公司 产品质量检验操作规程 部门:品控部 编制:范昌勇 文件编号:KDRQC018 日期:2015年1月12日 一、菌落总数检测操作规程 检测国标:GB 4789.2-2010食品安全国家标准食品微生物学检验菌落总数测定 样品:卡顿尔蛋糕、卡曲、西点类产品 产品国标:GB/T 20977-2007糕点通则;GB/T 20980-2007饼干 产品卫生标准:GB 7099-2003糕点、面包卫生标准; GB 7100-2003饼干卫生标准 菌落总数指标:糕点:热加工≤1500cfu/g,冷加工≤10000cfu/g
饼干:≤750cfu/g 试剂:生理盐水(约8.5%)(磷酸盐缓冲溶液);营养琼脂培养基(或平板计数琼脂培养基);75%消毒酒精 设备:电子称(0.01g)、电子万用炉、灭菌锅、恒温水浴锅、超净工作台、电热恒温培养箱 器具:250ml三角瓶、玻璃棒、烧杯(500ml)、试管(15*150或者18*180)、试管架、培养皿、镊子、钥匙、刻度吸量管(1ml、10ml)、移液器(100-1000ul)、酒精灯 操作步骤: 1.药品配制 营养琼脂培养基(配比:32g+1000ml蒸馏水);生理盐水(8.5gNaCl+1000蒸馏水)(或磷酸盐缓冲溶液);75%消毒酒精(500ml95%纯酒精+133ml蒸馏水)。 2.灭菌消毒准备 ⑴往灭菌锅外层锅内加适量的水(水位刚好没过加热管,最好用硬度较低的水,避免结垢而缩短加热管的寿命)。 ⑵培养皿成套同向整齐排列叠放,用干燥的牛皮纸(或者报纸)包裹卷紧,放入灭菌锅内套中。 ⑶将准备好的试管、培养基、刻度吸量管、移液器枪头、生理盐水放入锅内,注意不要放置过于密集紧凑,以免影响蒸汽循环造成灭菌不彻底。 ⑷盖好锅盖并对称地扭紧螺旋。 ⑸加热使锅内产生蒸汽,当压力表指针达到 33.78kPa时,打开排气阀,将冷空气排出,此时压力表指针下降,当指针下降至零时,即将排气阀关好。注意冷空气必须充分排除,否则锅内温度达不到规定温度,影响灭菌效果。 ⑹继续加热,锅内蒸汽增加,压力表指针又上升,当锅内压力增加到所需压力时,将火力减小(自动控制则无需手动操作,老式灭菌锅需手动切断电源来调节),使蒸汽压力升至103.4kPa,温度达121.3°C,维持15~20分钟,然后将灭菌器断电或断火,让其自然冷后再慢慢打开排气阀以排除余气,然后才能开盖取物。 ⑺无菌操作间和超净工作台紫外灯开启,关闭通道门,灭菌30-60分钟。 ⑻更衣进入无菌间,操作前用75%消毒酒精对手部、样品盒表面、操作台、试管架等进行喷洒消毒。 3.样品处理 卡顿尔产品(含半成品)均为固体和半固体样品,样品处理方法如下: 称取25 g 样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min 均质1 min~2 min,或放入盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 1:100样品液稀释方法:用1 mL无菌吸管或微量移液器吸取1:10样品匀液1 mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。按此操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次,换用1次1 mL无菌吸管或吸头。 4.接种培养
标准化质量管理制度
承赤高速公路第七合同段标准化质量管理制度 一、首件工程认可制对本标段每一个分项工程实行首件工程认可,以规范工程程 序化施工。 首件工程开工前上报分项工程开工报告,经驻地监理工程师审批在监理全过程旁站条件下开工,分项工程完成后驻地办、总监办会同项目工程师对首件工程进行验收,对施工工艺、验收程序、外观质量等进行认可。 对发现的问题进行整改并总结经验。对于好的施工工艺和措施采用现场观摩会的形式全线推广。 二、路基工程制度1、路基试验段 (1)在路堤施工前,选取长度200米具有代表性的段落进行路基试验段各项准备工作。0 (2)提前14天上报试验段开工报告,监理工程师审批后开始试验段填筑。开工报告的内容包括:人员,机械设备,施工工艺,质量、安全、环保和文明施工保证措施等详细说明。 (3)试验段填筑的目的:找出填料在最佳含水量下达到各压实区规定的压实度和压实沉降差时,施工机械最佳组合方式、碾压速度、碾压遍数、松铺厚度、施工工艺等。 (4)试验段结束后对平整度、横坡、高程、压实质量等各项指标检查验收,满足规范要求及时将施工情况及检测结果编制试验段施工总结报监理工程师审核批准,将其作为该填料施工控制的依据。 2、土方路堤常见质量问题的防治及管理措施- 1 - (1)中线偏位防治及管理措施 ①加固保护导线点至交工验收;②每填高60-80cm恢复一次路线中桩,测定路基标高及宽度; ③亏坡的一侧按照规范要求开台阶补填,多余的一侧进行削坡处理。对现场负责人、技术负责人和监理人员进行相应处罚。 )翻浆、“弹簧”现象防治及管理措施:(2①避免用天然稠度小于1.1,液限大于40,塑性指数大于18,含水量大于最佳含水量两个百分点的土作为路基填料。 ②土的实际含水量大于最佳含水量时,采取翻拌晾晒、加白灰或换填适宜的填料,达到要求后方可进行压实; ③清除碾压层下软弱层,换填良性土壤后重新碾压; )路基边缘压实度不够防治及管理措施:(3 ①路基施工必须按要求进行超宽填筑;②控制碾压工艺,保证机具碾压到边,确保边缘带碾压频率不低于行车带。 ③返工至符合压实度要求的层次。 (4)起皮、松散防治及管理措施:①起皮:严禁薄层贴补;低液限粉土填筑路 基时,碾压过程中应适量洒水; ②松散:适当洒水后重新碾压;冬季施工时填筑层碾压完毕后及时封土保温。(5)路基边坡冲刷防治及管理措施: ①削坡后及时进行边坡防护工程;②按要求设挡水埂和临时泄水槽,且随时保证完好并发挥作用;
碳酸钙质量标准及检验操作规程完整
1 目的:本标准规定了碳酸钙的质量标准及检验操作规程,以规操作。 2 围:本标准适用于公司购进的辅料碳酸钙质量检验。 3 职责:质量部QA、QC人员对本标准实施负责。 4 容:(质量标准) 4.1 法定标准(中国药典2015年版二部) 4.1.1 产品名称 4.1.1.1 中文名:碳酸钙 4.1.1.2 汉语拼音名: Tansuangai 4.1.1.3 英文名:Calcium Carbonate 不得少于98.5%。 本品按干燥品计算,含CaCO 3 4.1.2 性状:本品为白色极细微的结晶性粉末;无臭,无味。 本品在水中几乎不溶,在乙醇中不溶;在含铵盐或二氧化碳的水中微溶;遇稀醋酸、稀盐酸或稀硝酸即发生泡沸并溶解。 4.1.3 鉴别 4.1.3.1 取铂丝,用盐酸湿润后,蘸取本品在无色火焰中燃烧,火焰即显砖红色。 4.1.3.2 取本品约0.6g,加稀盐酸15ml,振摇,滤过,滤液加甲基红指示液2滴,用氨试液调至中性,再滴加稀盐酸至恰呈酸性,加草酸铵试液,即生成白色沉淀,分离,沉淀在醋酸中不溶,但在盐酸中溶解。 4.1.3.3 取本品适量,加稀盐酸即泡沸,产生二氧化碳气体,导入氢氧化钙试液中,即生成白色沉淀。 4.1.4 检查 4.1.4.1 氯化物取本品0.10g,加稀硝酸10ml,加热煮沸2分钟,放冷,必要时滤过,依法检查(中国药典2015年版通则0801),与标准氯化钠溶液3.0ml制成的对照液比较,不得更浓(0.03%)。 4.1.4.2 硫酸盐取本品0.10g,加稀盐酸2ml,加热煮沸2分钟,放冷,必要时滤过,依法检查(中国药典2015年版通则0802),与标准硫酸钾溶液2.0ml制成的对照液比较,不得更浓(0.2%)。 4.1.4.3酸中不溶物取本品2.0g,加水10ml,混合后,滴加稀盐酸,随滴随振摇,待泡沸停止,加水90ml,滤过,滤渣用水洗涤,至洗液不再显氯化物的反应,干燥后炽灼至恒重,遗留残渣不得过0.2%。 4.1.4.4干燥失重取本品,在105℃干燥至恒重,减失重量不得过1.0%(中国药典2015年版通则0831)。 4.1.4.5钡盐取本品2.0g,加水10ml,混合后,滴加稀盐酸使溶解,加水稀释至100ml ,用铂丝蘸取溶液,置无色火焰中燃烧,不得显绿色。 4.1.4.6镁盐与碱金属盐取本品1.0g,加水20ml与稀盐酸10ml溶解后,加甲基红指示液1滴,煮沸,滴加氨试液中和后,加过量的草酸铵试液使钙完全沉淀,置水浴上加热1 小时,放冷,加水稀释成100ml,搅匀,滤过,分取滤液50ml,加硫酸0.5ml,蒸干后,炽
白薇质量标准及检验操作规程
XXXXXXXX有限公司成品质量标准及检验操作规程 1 品名: 1.1 中文名:白薇 1.2 汉语拼音:Baiwei 2 代码: 3 取样文件编号: 4 检验方法文件编号: 5 依据:《中国药典》(2015年版一部)。 6 质量标准:
7 检验操作规程: 7.1 试药与试剂:甲醇、白薇对照药材、丁醇、乙酸乙酯、硫酸、乙醇、盐酸、硝酸、硝酸银、氨试液、二氧化锰、氢氧化钠滴定液、甲基红乙醇溶液指示剂。 7.2 仪器与用具:电子天平、烘箱、显微镜、硅胶G板、超声波清洗器、二
氧化硫测定仪。 7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。 7.4 鉴别: 7.4.1 取本品制片置10×10显微镜下做显微观察。 7.4.2 取本品粉末1g,加甲醇30ml,超声处理20分钟,放冷,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。另取白薇对照药材1g,同法制成对照药材溶液。照薄层色谱法(附录7)试验,吸取上述两种溶液各2μl,分别点于同一硅胶G薄层板上,以正丁醇-乙酸乙酯-水(4 :1 :5)的上层溶液为展开剂,展开,取出,晾干,喷以硫酸乙醇溶液(1→10),在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。 7.5 检查: 7.5.1 杂质不得过4%(附录12)。 7.5.2 水分不得过11.0%(附录15 第二法)。 7.5.3 总灰分不得过13.0%(附录17)。 7.5.4 酸不溶性灰分不得过4.0%(附录17)。 7.5.5二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。 7.6 浸出物:照醇溶性浸出物测定法(附录19)项下的热浸法测定,用稀乙醇作溶剂,不得少于19.0 %。
机构质量管理的标准操作规程
机构质量管理的标准操作规程 版本号 1.0 页数3页 起草人起草日期年月日审核人审核日期年月日批准人批准日期年月日颁布日期年月日起效日期年月日 威海市立医院 药物临床试验机构
机构质量控制的标准操作规程 一、目的 建立本机构药物临床试验质量检查制度,保障受试者的合法权益和生命安全,确保试验记录 和报告数据准确、完整可信。 二、范围 适用于在本机构开展的所有药物临床试验。 三、内容 1机构质量管理员根据试验项目的风险程度和研究时间制定质控计划,在临床试验首例入组后、过程和结束阶段至少进行三次质量检查。同时对在研项目进行登记。 2质量管理员应至少完成项目所有病例的30%的原始资料及CRF的检查。 3质量管理员对研究者对项目方案的执行力、研究人员的资历、知情同意过程、原始资料的记录、试验用药品的记录和管理、SAE记录与报告、专业组质控检查、申办方监查工作进行检 查。 4机构质量管理员在检查前3个工作日通知专业组检查计划,有因检查可随时到专业组检查。 5方案执行力检查: 1)入选、排除标准是否符合方案要求; 2)受试者是否按方案要求进行相关访视、检查; 3)受试者用药是否符合方案要求; 4)是否有对应临床试验方案的SOP; 5)是否有方案偏离/违背,并有相关记录和报告; 6)交通补贴等是否及时发放。 6研究团队检查: 1)研究人员是否参加了GCP培训及项目培训; 2)是否获得主要研究者授权。 7知情同意检查: 1)受试者在开始试验之前签署了知情同意书并注明了知情同意的日期; 2)进行知情同意说明的研究者在知情同意书上签字并注明了日期;
3)研究者在使用伦理委员会批准的最新版知情同意书; 4)研究者保留了受试者的签字并标注日期完整的知情同意书原件; 5)确认受试者签名真实性。 8临床试验原始记录检查: 1)获得知情同意过程的记录; 2)原始记录真实、完整、可溯源; 3)CRF是否在一周内完成填写; 4)所有退出失访均有说明; 5)错误或遗漏修改规范; 6)实验室检查有报告单或者复印件; 7)报告单是否及时签名、判断; 8)方案偏倚/违背记录; 9)合并用药记录。 9试验用药品检查: 1)试验药物的入库、出库登记是否完整规范; 2)试验药物接收、使用、返还记录是否完整、规范; 3)是否有试验用药发放记录; 4)退回的剩余试验药物,交接记录是否完整,有无销毁或者返还机构药房的记录; 5)是否存放在带锁的临床试验专用药柜,由专人管理,并定期清点; 6)药物存放温度是否符合标准,记录是否完整规范; 7)注射药物是否有需要配置并有配置记录; 8)注射药物是否有输注开始、结束时间记录及签名; 9)药量与用法是否遵照试验方案。 10SAE检查: 1)是否及时、准确、规范地填写《严重不良事件报告表》; 2)是否在获知24小时内报送CFDA、申办方、伦理委员会、药物临床试验机构、总后卫生 部药材局; 3)对于正在持续的SAE,研究者是否密切跟踪并完成后续“随访报告”、“总结报告”,也需 及时报送CFDA、申办方,伦理委员会,药物临床试验机构。 11专业组质控检查: 1)是否有ICF检查记录; 2)是否有方案执行情况检查记录; 3)是否有原始数据检查记录; 4)是否有试验药品检查记录;
浅析企业标准化体系与质量管理体系的关系
浅析企业标准化体系与质量管理体系的关系 段锦伶 (湖北省襄樊卷烟厂) 1.当今的质量管理与标准化管理 著名的质量管理专家石川馨先生多次强调“标准化与质量管理是企业赖以生存的两只轮子,二者是缺一不可的”。这表述了标准化与质量管理管理之间的密不可分的特殊关系。质上标准化是“载体”,质量管理是“应用”,“载体”是“应用”的依据,“应用”是“载体”的实现,二者之间相互依存,不可分割。 然而质量管理的标准化和标准化的质量管理是两个不同的概念,不能认为搞质量管理就是搞标准化。推行ISO9000标准,也不能象执行产品标准那样一成不变,更不是要使各企业的质量体系都标准化。诚然企业要建立一个符合生产管理实际需要的质量体系,自始至终都离不开标准化,尤其是体系文件的编制更是如此。从宏观上讲,管理必须要多样化,即各企业要根据自己的实际和管理需要,对ISO9000给出的体系要素加以适当的选择和增删。应防止形式主义和教条主义的照抄照搬。管理强调的是协调和规范,其中可以用标准来进行,亦可以用法规、管理性文件或其它方法来约定,不管以何种方法,均应形成有效的文件。 2.标准化体系与质量管理体系不能相互取代 既然标准化体系与质量管理体系有如此密切的关系。那么,它们两者之间能否相互取代呢?对此问题,笔者认为,企业标准化体系是否建立在以技术标准为主体,包括工作标准和管理标准在内的企业标准化系统,以便使企业在产品、技术、生产、人事、财务、后勤等各个方面建立起以各自标准为依据的管理体系。 而企业的质量体系,则是为实施质量管理和质量保证以及实现质量目标而建立的综合体。它是由若干要素组成的,这些要素是企业质量管理活动的主要内容,每个要素的实施都需要建立相应的规定或制订相关的标准做为支撑条件,其中大量的是管理标准(包括工作标准)。而建立质量体系的目的,就是要保证产品质量,达到规定的质量要求,要做到这一点,关键在于采取有效的措施控制影响质量的各个因素。以满足实物质量的标准要求和顾客的市场要求。因此,标准化体系和质量管理体系之间只能相互补充,而不能相互取代。两个体系都是企业管理系统的子系统。 3.标准化体系与质量管理体系的“包容性”与“兼容性” 从客观上看,企业的标准化体系可谓是企业各项管理体系之中最大的工作系统。它几乎覆盖了企业的的方方面面、所有环节,并渗透到各项管理工作之中,体现了管理上的全息性。因此,企业标准化体系对包括质量体系在内的各项管理性工作具有相当大的包容性。而企业
白头翁质量标准及检验操作规程
XXXXXXXXXXXX有限公司原料质量标准及检验操作规程 1 品名: 1.1 中文名:白头翁 1.2 汉语拼音:Baitouweng 2 代码: 3 取样文件编号: 4 检验方法文件编号: 5 依据:《中国药典》(2020年版一部)。 6 质量标准:
7 检验操作规程: 7.1 试药与试剂:甲醇、水、白头翁对照药材、正丁醇、醋酸、水、硫酸、乙醇、白头翁皂苷B4对照品、盐酸。
7.2 仪器与用具:显微镜、水浴锅、超声波清洗器、恒温鼓风干燥箱、高效液相色谱仪、马福炉、硅胶G薄层板。 7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。 7.4 鉴别: 7.4.1 取本品制片置10×10显微镜下做显微观察。 7.4.2取本品粉末1g,研细,加甲醇10ml,超声处理10分钟,滤过,取滤液作为供试品溶液。另取白头翁对照药材1g,同法制成对照药材溶液。照薄层色谱法(附录7)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以正丁醇-醋酸-水(4:1:2)的上层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点。 7.5 检查: 7.5.1水分不得过13.0%(附录15第二法)。 7.5.2总灰分不得过11.0%(附录17)。 7.5.3酸不溶性灰分不得过6.0%(附录17)。 7.5.4二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。 7.6 浸出物:照醇溶性浸出物测定法(附录19)项下的冷浸法测定,用水饱和的正丁醇作溶剂,不得少于17.0%。 7.7 含量测定:照高效液相色谱法(附录8)测定。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-水(64:36)为流动相;检测波长为201nm。理论板数按白头翁皂苷B4峰计算应不低于3000。
浅谈标准体系和质量管理体系之间的关系
浅谈标准化体系和质量管理体系之间的关系 钻井三公司张岭岭 摘要:体系运行贯穿现代企业管理的各个方面,体系运行依靠各种标准,而标准化体系为建立企业的各项管理体系提供了依据,本文通过对标准化体系和质量管理体系的结构和实施要求进行分析,阐述了标准化体系与质量管理体系相互之间的关系,说明了标准化体系与质量体系之间不可相互取代,并且具有包容性与兼容性的密切联系。 关键词:体系运行标准化体系质量管理体系关系 1.企业标准化管理体系概况 1.1企业标准化管理体系的建立 建立企业标准化体系要以贯彻落实国家关于标准化工作的法律、法规、政策、方针为基础,以建立健全以技术标准为主体核心,以管理标准为支持,以工作标准为保障。企业要建立统一管理部门,负责编制适应本企业的标准化管理体系,并管理实施和对标准的实施情况进行监督。 1.2 企业标准化管理体系的构成 企业标准体系应以技术标准体系为主,包括为实现技术标准的要求而建立的管理标准体系、工作标准体系,以及为有效进行研制生产而规定的各项标准化管理要素。 企业技术标准的形式可以是标准、规范、规程、守则、操作卡、作业指导书等。管理标准是生产经营活动和实现技术标准的重要措施,它把企业管理的各个方面以及各个单位、部门岗位有机地结合起来,统一到产品质量的管理上,以获得最大的经济效益。 管理标准是对有关生产、技术、经营管理各个环节运用标准化原理所作的规定,它涉及各个管理方面,包括企业经营决策管理、
生产管理、技术管理、质量管理、计划管理、人事管理、财务管理、设备管理、物资供运销管理、经济实体管理、以及标准化管理等。 工作标准是生产高质量产品、提高生产经营效率、实现各项技术标准的重要保证。具体来说,工作标准是对各部门、单位的各类人员的基本职责、工作要求、考核办法所作的规定,包括职责权利、工作程序、办事细则、考核标准和相互关系准则等。企业标准体系的组成形式见图1。 图1 企业标准体系的组成形式 1.3管理标准为质量管理提供依据 著名的质量管理专家石川馨先生指出,企业标准可以作为一个“载体”,质量管理则是企业标准体系在企业中的一项应用。也就突出了“载体”是“应用的依据,“应用”是“载体”的实现,二者之间相互依存,不可分割。标准化与质量管理是企业赖以生存的两只轮子,二者是缺一不可的”。标准化与质量管理管理之间的密不可分的特殊关系。 2.质量管理体系概述 2.1质量管理体系定义
实验室检测质量控制标准操作规程
实验室检测质量控制标准操作规程 Ⅰ.目的:建立实验室检测质量控制标准操作规程,保证实验室记录与报告数据及时、准确、可靠。 Ⅱ.范围:适用于所有临床试验。 Ⅲ.规程: 1.实验室质控要求: 1.1.实验室要建立观测实验指标的标准操作规程和质量控制程序,优化检测条 件。 1.2.实验室应用标准的方法学,遵从GCP,遵从当地法规。 1.3.规定实验室检查的观测项目、测定的次数和观测时间。 2.实验室检查符合质量控制要求。质量控制考核要点:实验室检验质量控制,实验室仪器操作质量控制,实验室仪器与设备质量控制,机构与所在医疗机构外实验室协作,标准品测定考核。实验室质控证明文件包括的几个方面:实验室环境条件,检验人员资质,仪器设备运行状态和质量控制,实验方法操作规程和质量控制,试剂的来源和管理。 3.特殊实验室检查项目标准操作程序:所采用的具体方法,包括试剂来源,标本收集方法,应用的仪器类别、型号、测试程序和方法等。 4.保证测定结果准确性的措施: 4.1.实验室条件,诸如仪器、检测环境、检测方法和操作人员的相对恒定。4.2.建立操作规程和操作卡片。 4.3.临床生化检验的室内质量控制,由专人负责,设立质量控制图。 4.4.针对特殊检查项目质控的措施 ①实验操作:质控血清及试剂现用现配,加样要准确,质控数值不超出 1.5SD~2SD,允许操作正常进行,记录每次质控数据,画出质控图、月终 统计,计算CV值,须小于3%。 ②室间控制:为减少室间的测量误差,最好统一试剂(同一厂家),同一质 控血清,以观察各室之间的测量差距,仪器不易统一,但必须保养到最佳
状态。经常进行仪器的自身校准。 ③临床试验应在同一时期进行,以减少季节给测量带来的误差。
质量标准、操作规程的制定
扶桑帝药(青岛)有限公司标准操作规程 题目质量标准和检验操作规程的制定、审批及管理 规程 编号SOP4-027-02 页码1/2 制定审核批准 日期年月日日期年月日日期年月日颁发部门质保科颁发数量份生效日期年月日分发部门质保科□质控科□ 1. 目的 规定原辅材料、半成品、成品质量标准和检验操作规程的制订、审批及管理。 2. 适用范围 适用于制订所有原辅材料、半成品、成品的质量标准和检验操作规程。 3. 职责 质保部: 负责质量标准的制定、审批及管理; 研究开发部、质控部:负责提供相关数据及信息; 质控部:负责检验操作规程的制定。 4. 内容 4.1. 质量标准、检验操作规程的制定 4.1.1 质保部质量管理员按照现行《药品生产质量管理规范》、《中国药典》、国家部颁标准、 注册标准等基本要求起草制定,编写时必须按照公司文件格式要求,根据有关标准,结合公司实 际情况进行编写,在制定过程中参考研究开发部、质控部根据供货厂家提供的质量标准和公司的 工艺要求而制定的企业内控标准。 4.1.2 质控部质检员结合公司情况起草制定检验操作规程。 4.2. 质量标准、检验操作规程的审批 4.2.1 质保部负责人负责对质量标准的内容、编号、格式,对该质量标准与其他相关文件的统一 性、质量标准内容的先进性、合理性及可操作性进行把关,对质量标准进行审批。 4.2.2 质量控制部负责人必须保证测试方法在现有设施和设备条件下有效,必要时对测试方法的准 确度、灵敏度、专属与重现性进行验证,对检验操作规程进行审批。 4.3. 质量标准、检验操作规程的管理 4.3.1 质量标准与检验操作规程生效后由质保部人员按照签发部门复印,盖上受控章下发,填写文 件发放记录,原件由质保部负责保留。 4.3.2 当质量标准和检验操作规程有新版本时,质保部旧版本原件盖上作废章,其他发放部门旧版 本由质保科人员销毁。 4.3.3 质量标准的变更,必要时应报药政部门批准或备案。原则上,质量标准和测试方法1-2 年 修订一次。 5. 编号系统 根据代号表用名称和代号来区别每一份质量标准与检验操作规程,此外,以质量标准代号及 测试方法代号分别编写这些资料的索引表。这些号码包括原材料或成品的代号和一个用以指 明资料版数的附加数字。如S“00-337-1 ”;M“00-337-1 ”。 当某一品种质量标准的内容需要更动时,则需改变版本的版数数字并须颁发该资料的新版 本,同时将相应的测试方法进行修改,以使和新版质量标准一致。
实验室质量与标准化管理
实验室质量与标准化管理 【摘要】:本文简述了ISO/IEC17025:1999国际标准的主要内容和实验室的标准化以及实行实验室质量与标准化管理管理的益处,阐述了实验室质量与标准化管理存在的主要问题,总结了实验室质量与标准化管理的关键控制点 【关键词】:实验室认可质量标准化管理 正文: 一、实验室标准化 实验室认可是指:权威机构对实验室有能力进行规定类型的检测和(或)校准所给予的正式承认,该定义包含了:第一、认可的实施组织是权威机构;第二、具备法律地位或能够承担法律责任的实验室自愿申请;第三、有资质的评审员和专家进行评审。实验室认可对实验室的标准化管理是很有意义的,也是必要的。实验室认可有利于实验室公正。实验室通过认可的前提就是按照国际标准ISO/IEC17025:1999运行足够时间(一般至少6个月)并保证持续稳定运行。认可机构必要时通过采取跟踪措施进行监控,如采用监督评审、复评审以及安排能力验证活动等措施,这将有助于实验室持续施行规范化管理,也有利于确保实验室的公证性。通过认可可以使实验室结果获国际承认。实验室认可是确定实验室从事特定类型检测、测量和校准技术和能力的一种方式,认可实验室发布带有认可机构标识和认可编号的检测或校准报告表明其认可地位。世界上许多国家,特别是经济发达国家,都有专门机构负责对其国内实验室进行认可,这些认可机构中的大部分现已采用ISO/IEC17025:1999标准作为认可其国内检测和校准实验室的基础。实验室认可在国内和国际上被高度视为技术能力的可靠表征,在很多行业,检测任务须交由通过认可实验室来完成已完成为目前通常方式。 二、实验室质量与标准化管理的益处 1)检测/校准结果可以得到国内和国际上的承认;2)提高社会共总和政府部门的信任度;3)支持其他各种认证和认可活动;4)支持企业质量管理活动以及产品和服务的质量;5)为决策者提供可以信赖的检测/校准结果;6)提高一次检测/校准的成功率而节约成本和开支。 三、实验室质量与标准化管理存在的主要问题 1、缺乏对使用新标准检验方法的确认 认为新标准检验方法经批准颁布已是成熟的方法,可拿来就用,没有考虑要通过实验来对新标准检验方法是否理解、掌握和正确地运用进行确认。 2、缺乏对仪器鉴定/校准结果的确认
质量检验标准操作规程
目的:阐述企业质量标准和检验操作规程的内容要求以及制订、审核、批准、分发、修订、废除、销毁、保管等管理规定,确保符合生产和质量管理实际情况和国家有 关法定要求。 范围:适用于原料、辅料、包装材料、中间产品和成品等企业内控标准和检验操作规程的制订、审核、批准、分发、修订、废除、销毁、保管等管理。 职责:质量管理中心对此规程的实施负责。 规程: 1标准是对重复性事物或概念所作的统一规定,它以科学技术和实践经验的综合成果为基础,经有关方面协商一致,由主管机关批准,以特定的形式发布, 作为共同遵守的准则和依据。 2药品必须符合国家药品标准。国务院药品监督管理部门颁布的《中华人民共和国药典》和药品标准为国家药品标准。中药饮片必须按照国家药品标准炮 制;国家药品标准没有规定的,必须按照湖北省药品监督管理部门制定的炮 制规范炮制。 3公司必须执行各级法定标准,在法定标准的基础上,公司结合企业的实际情况制订和执行企业内控标准、检验操作规程,企业内控标准必须高于法定标 准。下列情况必须制订企业内控质量标准(简称企业标准,下同。): (1)成品; (2)中间产品; (3)原料、辅料、包装材料; (4)工艺用水。 4企业标准的主要内容: 4.1药材企业标准的主要内容,是指除文件表头外的正文内容,按顺序可排有: (1)品名,包括中文名称(必要时用括号加注副名)、汉语拼音名、拉丁名; (2)规格、代号; (3)标准出处(须详细写明出处); (4)检验操作规程题目及编号;
(5)来源,指药材原植(动)物的科名、植(动)物名、学名、药用部位(矿物药注明类、族、矿石名或岩石名、主要成分)及采收季节和产 地加工等; (6)企业质量标准(注明性状、鉴别、检查、浸出物、含量测定等检验项目及法定标准、企业内控标准); (7)炮制; (8)贮藏条件及贮存期。 4.2化学原辅料企业标准的主要内容,是指除文件表头外的正文内容,按顺序可 排有: (1)品名,包括中文名称、汉语拼音名、英文名; (2)分子式、分子量; (3)来源或有机药物的化学名称; (4)规格、代号; (5)标准出处(须详细写明出处); (6)检验操作规程题目及编号; (7)企业质量标准(注明性状、鉴别、检查、含量测定等检验项目及企业标准等); (8)类别; (9)贮藏条件及贮存期。 4.3包装材料企业标准的主要内容,是指除文件表头外的正文内容,按顺序可排 有: (1)品名、规格、代号; (2)引用标准(须详细写明出处); (3)检验操作规程题目及编号; (4)材质、外观、尺寸、理化项目(内包装材料须有符合药品要求的卫生标准)等检验项目及企业标准、检验依据; (5)类别; (6)适用范围;
