脱氢酶活性测定实验报告
脱氢酶活性测定实验报告
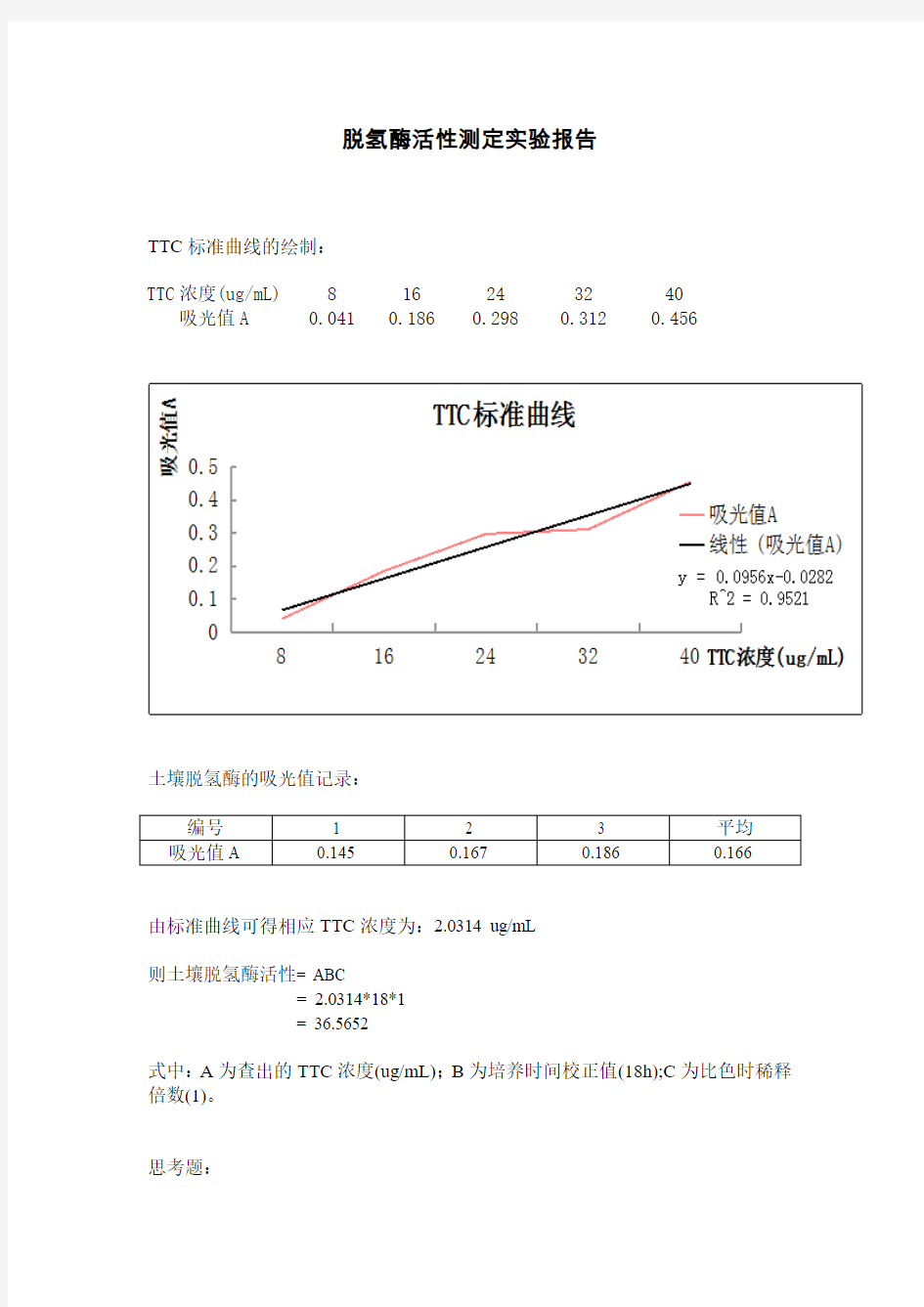
TTC标准曲线的绘制:
TTC浓度(ug/mL) 8 16 24 32 40 吸光值A 0.041 0.186 0.298 0.312 0.456
土壤脱氢酶的吸光值记录:
编号 1 2 3 平均吸光值A 0.145 0.167 0.186 0.166
由标准曲线可得相应TTC浓度为:2.0314 ug/mL
则土壤脱氢酶活性= ABC
= 2.0314*18*1
= 36.5652
式中:A为查出的TTC浓度(ug/mL);B为培养时间校正值(18h);C为比色时稀释倍数(1)。
思考题:
1.影响脱氢酶活性的因素有哪些?
答:pH:每种酶都有最适pH,在此pH下,酶活性最大;
温度:酶活性随着温度的升高而增加,在最适温度时达到最高值,然
后开始下降;
激活剂:可以促进酶活性;
抑制剂:会使酶活性降低;
还有内因如底物浓度和酶浓度。
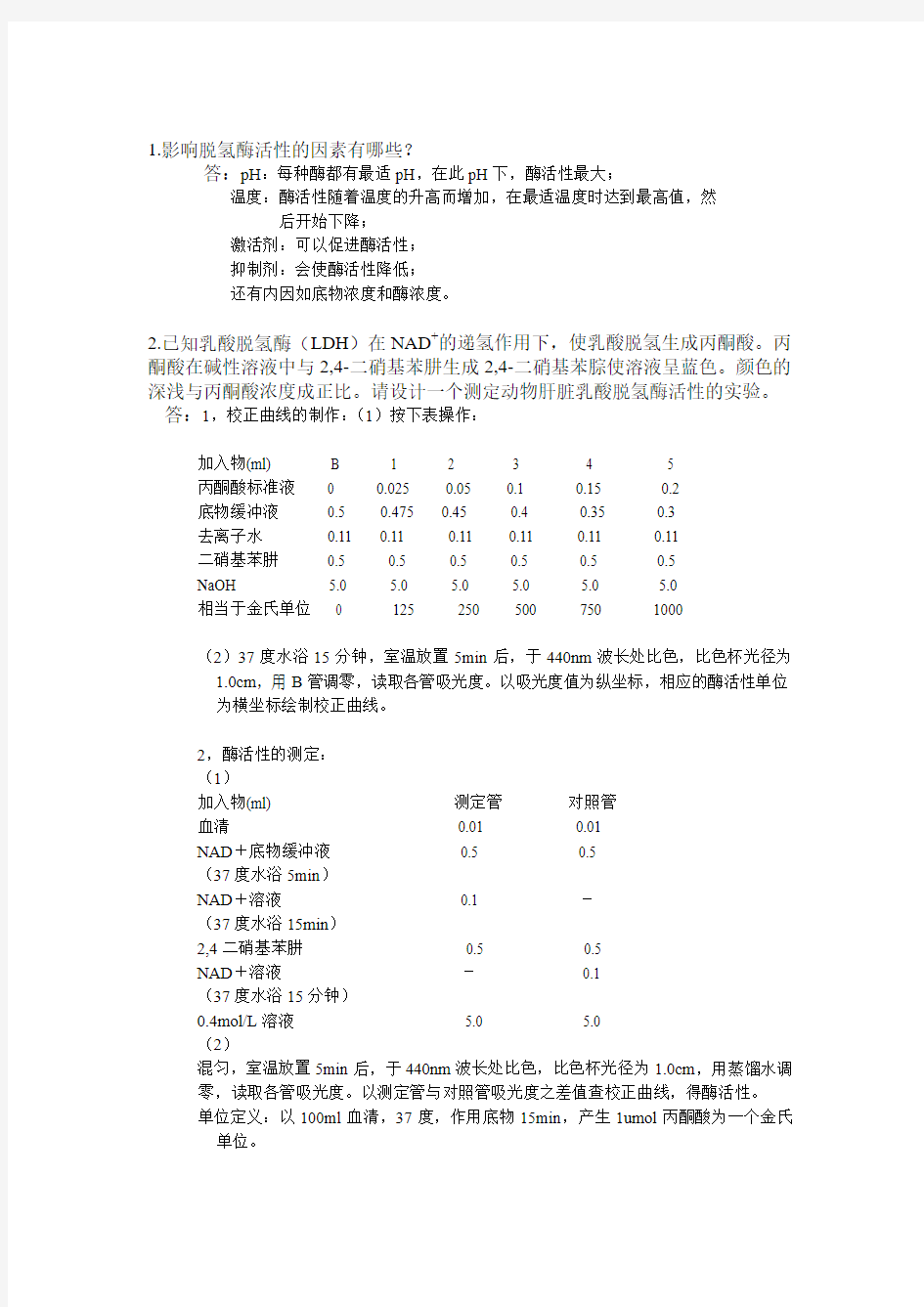
2.已知乳酸脱氢酶(LDH)在NAD+的递氢作用下,使乳酸脱氢生成丙酮酸。丙酮酸在碱性溶液中与2,4-二硝基苯肼生成2,4-二硝基苯腙使溶液呈蓝色。颜色的深浅与丙酮酸浓度成正比。请设计一个测定动物肝脏乳酸脱氢酶活性的实验。答:1,校正曲线的制作:(1)按下表操作:
加入物(ml) B 1 2 3 4 5
丙酮酸标准液0 0.025 0.05 0.1 0.15 0.2
底物缓冲液0.5 0.475 0.45 0.4 0.35 0.3
去离子水0.11 0.11 0.11 0.11 0.11 0.11
二硝基苯肼0.5 0.5 0.5 0.5 0.5 0.5
NaOH 5.0 5.0 5.0 5.0 5.0 5.0
相当于金氏单位0 125 250 500 750 1000
(2)37度水浴15分钟,室温放置5min后,于440nm波长处比色,比色杯光径为
1.0cm,用B管调零,读取各管吸光度。以吸光度值为纵坐标,相应的酶活性单位
为横坐标绘制校正曲线。
2,酶活性的测定:
(1)
加入物(ml) 测定管对照管
血清0.01 0.01
NAD+底物缓冲液0.5 0.5
(37度水浴5min)
NAD+溶液0.1 -
(37度水浴15min)
2,4二硝基苯肼0.5 0.5
NAD+溶液-0.1
(37度水浴15分钟)
0.4mol/L溶液 5.0 5.0
(2)
混匀,室温放置5min后,于440nm波长处比色,比色杯光径为1.0cm,用蒸馏水调零,读取各管吸光度。以测定管与对照管吸光度之差值查校正曲线,得酶活性。
单位定义:以100ml血清,37度,作用底物15min,产生1umol丙酮酸为一个金氏单位。
电动势的测定及其应用(实验报告)
实验报告 电动势的测定及其应用 一.实验目的 1.掌握对消法测定电动势的原理及电位差计,检流计及标准电池使用注意事项及简单原理。 2.学会制备银电极,银~氯化银电极,盐桥的方法。 3.了解可逆电池电动势的应用。 二.实验原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极上发生还原反应,负极则发生氧化反应,电池反应是电池中所有反应的总和。 电池除可用作电源外,还可用它来研究构成此电池的化学反应的热力学性质,从化学热力学得知,在恒温、恒压、可逆条件下,电池反应有以下关系: △r G m =-nFE 式中△r G m 是电池反应的吉布斯自由能增量;n 为电极反应中电子得失数;F 为法拉第常数;E 为电池的电动势。从式中可知,测得电池的电动势E 后,便可求得△r G m ,进而又可求得其他热力学参数。但须注意,首先要求被测电池反应本身是可逆的,即要求电池的电极反应是可逆的,并且不存在不可逆的液接界。同时要求电池必须在可逆情况下工作,即放电和充电过程都必须在准平衡状态下进行,此时只允许有无限小的电流通过电池。因此,在用电化学方法研究化学反应的热力学性质时,所设计的电池应尽量避免出现液接界,在精确度要求不高的测量中,常用“盐桥”来减小液接界电势。 为了使电池反应在接近热力学可逆条件下进行,一般均采用电位差计测量电池的电动势。原电池电动势主要是两个电极的电极电势的代数和,如能分别测定出两个电极的电势,就可计算得到由它们组成的电池电动势。 附【实验装置】(阅读了解) UJ25型电位差计 UJ25型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或 mV V 17110-μ(1K 置10?档) 。使用V V 4.6~7.5外接工作电源,标准电池和 灵敏电流计均外接,其面板图如图5.8.2 所示。调节工作电流(即校准)时分别调节1p R (粗调)、2p R (中调)和3p R (细 调)三个电阻转盘,以保证迅速准确地调 节工作电流。n R 是为了适应温度不同时标准电池电动势的变化而设置的,当温 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
物化实验报告燃烧热的测定
华南师范大学实验报告 一、实验目的 1、明确燃烧热的定义,了解定压燃烧热与定容燃烧热的差别。 2、掌握量热技术的基本原理;学会测定萘的燃烧热 3、了解氧弹量热计的主要组成及作用,掌握氧弹量热计的操作技术。 4、学会雷诺图解法校正温度改变值。 二、 实验原理 通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值T ?,就能计算出该样品的燃烧热。 ()p V Q Q RT n g =+? (1) ()V W W Q Q C W C M +=+样品21总铁丝铁丝水水(T -T ) (2) 用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T ?。 便可据上式求出K ,再用求得的K 值作为已知数求出待测物(萘)的燃烧热。 三、仪器和试剂 1.仪器 SHR-15氧弹量热计1台;贝克曼温度计;压片机 2台;充氧器1台;氧气钢瓶1个;1/10℃温度计;万能电表一个;天平 2.试剂 铁丝;苯甲酸(AR);萘(AR );氧气 四、实验步骤 1、测定氧氮卡计和水的总热容量 (1)样品压片:压片前先检查压片用钢模,若发现钢模有铁锈油污或尘土等,必须擦净后,才能进行压片,用天平称取约0.8g 苯甲酸,再用分析天平准确称取一根铁丝质量,从模具的上面倒入己称好的苯甲酸样品,徐徐旋紧 压片机的螺杆,直到将样品压成片状为止。抽出模底的托板,再继续向下压,使模底和样品一起脱落,然后在分析天平上准确称重。 分别准确称量记录好数据,即可供燃烧热测定用。 (2)装置氧弹、充氧气:拧开氧弹盖,将氧弹内壁擦净,特别是电极下端的不锈钢接线柱更应擦十净,将点火丝的两端分别绑紧在氧弹中的两根电极上,选紧氧弹盖,用万用表欧姆档检查两电极是否通路,使用高压钢瓶时必须严格遵守操作规则。将氧弹放在充氧仪台架上,拉动板乎充入氧气。 (3)燃烧温度的测定:将充好氧气后,再用万用表检查两电极间是否通路,若通路将氧弹放入量热计内简。用量筒称3L 自来水,倒入水桶内,装好搅拌轴,盖好盖子,将贝克曼温度计探头插入水中,此时用普通温度计读出水外筒水温和水桶内的水温。接好电极,盖上盖了,打开搅拌开关。待温度温度稳定上升后,每个半分钟读取贝克曼温度计一次,连续记
燃烧焓的测定_物化实验
图1 量热氧弹 实验四 燃烧焓的测定 冷向星 2010011976 材03班(同组实验者:琦) 实验日期:2012-4-5 带实验的老师:春 1 引言 有机化合物的生成焓难以直接从实验中测定,然而有机化合物易于燃烧,含碳、氢和氧等三种元素的有机化合物完全燃烧时生成二氧化碳和水。从有机化合物燃烧的热效应数据也可以估算反应热效应。 通常燃烧焓在等容条件下测定(即称为“氧弹”的不锈钢容器中燃烧),所得数据为值,经换算后可得出值。 1.1实验目的 1.使用弹式量热计测定萘的燃烧焓。 2.了解量热计的原理和构造,掌握其使用方法。 3.掌握热敏电阻测温的实验技术。 1.2实验原理 当产物的温度与反应物的温度相同,在反应过程中只做体积功而不做其它功时,化学反应吸收或放出的热量,称为此过程的热效应,通常亦称为“反应热”。热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m 。通常,C 、H 等元素的燃烧产物分别为CO 2(g)、H 2O(l)等。由于上述条件下ΔH=Q p ,因此ΔC H m 也就是该物质燃烧反应的等压热效应Q p 。 在实际测量中,燃烧反应常在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q V (即燃烧反应的摩尔燃烧能变ΔC U m )。若反应系统中的气体物质均可视为理想气体,根据热力学推导,ΔC H m 和ΔC U m 的关系为: p V Q Q nRT =+? (1) 测量热效应的仪器称作量热计,量热计的种类很多,一般测量燃烧焓用弹式量热计。本实验是用氧弹式量热计进行萘的燃烧焓的测定,结构如图1。实验过程中外水套保持恒温,水桶与外水套之间以空气隔热。同时,还把水桶的外表面进行了电抛光。这样,水桶连同其中的氧弹、测温器件、搅拌器和水便近似构成了一 个绝热系统。 将待测燃烧物质装入氧弹中,充入足够的氧气。氧弹放入装有一定量 水的桶中,盖好外桶盖。以电控部分各开关控制搅拌并实现燃烧点火,用 热敏电阻作为测温元件,用电子自动平衡记录仪连续记录桶水温度的变化。 当某样品连同辅助物质棉线、金属丝燃烧后,下式成立:
原电池电动势的测定实验报告
实验九 原电池电动势的测定及应用 一、实验目的 1.测定Cu -Zn 电池的电动势和Cu 、Zn 电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC -Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=- (9-1) 式中G ?是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -?);E 为电池的电动势。所以测出该电池的电动势E 后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22() ()2Zn Zn s Zn a e ++-+ 正极起还原反应: 22()2()Cu Cu a e Cu s ++-+ 电池总反应为: 2222()()()()Cu Zn Zn s Cu a Zn a Cu s ++++++ 电池反应的吉布斯自由能变化值为: 22ln Cu Zn Zn Cu a a G G RT a a ++?=?- (9-2) 上述式中G ?为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221Cu Zn a a ++==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn Cu a RT E E nF a + + =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1 ln 2Cu Cu Cu RT F a ??+ + += - (9-6) 22,1 ln 2Zn Zn Zn RT F a ??+ + -= - (9-7) 式中2,Cu Cu ? +和2,Zn Zn ?+是当221Cu Zn a a ++==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
植物脱氢酶(PDHA)活性检测试剂盒说明书 微量法
植物脱氢酶(PDHA)活性检测试剂盒说明书微量法 注意:正式测定前务必取2-3个预期差异较大的样本做预测定。 货号:BC3125 规格:100T/48S 产品内容: 试剂一:粉剂×2瓶。使用前加少量水溶解,定容至50mL,避光、4℃保存(尽量现配现用)。 试剂二:液体100mL×2瓶,4℃保存。 试剂三:乙酸乙酯,自备。 产品说明: 生物体的脱氢酶(Plant dehydrogenase,PDHA)的活性在很大程度上反映了生物体的活性状态,能直接表示生物细胞对其基质降解能力的强弱。 受氢体2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyl Tetrazolium Chloride,即TTC)在细胞呼吸过程中接受氢以后,其还原产物三苯基甲替(TriphenylFormazone,即TFF)呈现红色,在波长485nm处有最大吸收峰,采用分光光度法于485nm测定其吸光值,即得植物脱氢酶活性。 试验中所需的仪器和试剂: 台式离心机、可见分光光度计/酶标仪、水浴锅、微量玻璃比色皿/96孔板(非聚苯乙烯/聚丙烯材质)、可调式移液枪、研钵/匀浆器、冰、蒸馏水、乙酸乙酯(不允许快递,请用户自备)。 操作步骤: 一、样品处理: 称取0.1g的植物组织,用双蒸水清洗3-4次,用滤纸吸干水分,备用。 二、测定步骤: 1、可见分光光度计/酶标仪预热30min以上,调节波长至485nm,乙酸乙酯调零。 2、操作表:取5mLEP管依次加入
对照管测定管 样品(g)0.10.1 试剂一(mL)1 试剂二(mL)21 充分混匀,37℃,暗培养3h,取出后立即冰浴5min,去滤液,尽量用滤纸吸干样品,置于研钵/匀浆器中。 试剂三(mL)11 充分研磨(建议在通风橱操作)后全部移至于离心管中,用少量试剂三冲洗研钵,一起加入离心管,用试剂三定容至2mL,10000rpm/min,4℃,离心5min,取200μL上清至微量 玻璃比色皿或96孔板中,测定485nm下的吸光值。计算ΔA=A测定-A对照。 三、脱氢酶活力计算 A:用微量玻璃比色皿(光径,1cm)测定的计算公式如下 酶活单位定义:在37℃时,每小时每克组织样品使反应体系吸光值每增加0.01为一个酶活单位。 脱氢酶活性(U/g/h)=ΔA÷0.01÷T÷W=33×ΔA÷W。 B:用96孔板(光径,0.5cm)测定的计算公式如下 酶活单位定义:在37℃时,每小时每克组织样品使反应体系吸光值每增加0.005为一个酶活单位。 脱氢酶活性(U/g/h)=ΔA÷0.005÷T÷W=66.7×ΔA÷W。 T:反应时间,3h;W:样品鲜重,g。 注意事项: 1.配制好的试剂一避光保存于4℃,尽量在一周内使用,若出现红色,则不能使用。 2.试剂三易挥发,有毒,为了您的健康,请穿实验服,戴口罩,戴乳胶手套操作。 3.反应完成后立即冰浴以终止反应,并去除干净残留的反应液。 4.如果测定出来的吸光值较大,需把样品适当稀释再进行测定,注意计算公式乘以稀释倍数。 5.如果用96孔板进行检测,建议不要使用聚苯乙烯/聚丙烯材质的96孔板。
燃烧焓的测定-2006030027
燃烧焓的测定 吴大维 2006030027 生64 同组实验者:王若蛟 实验日期:2008年3月7日提交报告日期:2008年3月21日 助教:卢晋 1引言 1.1 实验目的 1.使用弹式量热计测定萘的燃烧焓。 2.了解量热计的原理和构造,掌握其使用方法。 3.掌握热敏电阻测温的实验技术。 1.2 实验原理 当产物的温度与反应物的温度相同,在反应过程中只做体积功而不做其它功时,化学反应吸收或放出的热量,称为此过程的热效应,通常亦称为“反应热”。热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m。通常,C、H等元素的燃烧产物分别为CO2(g)、H2O(l)等。由于上述条件下ΔH=Q p,因此ΔC H m也就是该物质燃烧反应的等压热效应Q p。 在实际测量中,燃烧反应常在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q V(即燃烧反应的摩尔燃烧内能变ΔC U m)。若反应系统中的气体物质均可视为理想气体,根据热力学推导,ΔC H m和ΔC U m的关系为: (1)式中,T为反应温度(K);ΔC H m为摩尔燃烧焓(J·mol-1);ΔC U m为摩尔燃烧内能变(J·mol-1);v B(g)为燃烧反应方程中各气体物质的化学计量数。产物取正值,反应物取负值。通过实验测得Q V值,根据上式就可计算出Q p,即燃烧焓的值ΔC H m。 测量热效应的仪器称作量热计,量热计的种类很多,一般测量燃烧焓用弹式量热计。本实验是用氧弹式量热计进行萘的燃烧焓的测定,结构如上图。
实验过程中外水套保持恒温,内水桶与外水套之间以空气隔热。同时,还把内水桶的外表面进行了电抛光。这样,内水桶连同其中的氧弹、测温器件、搅拌器和水便近似构成了一个绝热系统。 量热仪的外桶盖为提升式。将其向上提到限位高度,顺时针旋转约90度,便可停放住。点火电极的上电极触头、内水桶搅拌器及测温器件均固定在外桶盖上,当把桶盖旋转到适当位置降下时,它们便都处于预定位置。搅拌器的马达也固定在外桶盖上,其电源线及点火电极连线经桶盖内部与量热仪的电控部分连通。氧弹的另一极经弹杯、内水桶及外水套与电控部分连通。 将待测燃烧物质装入氧弹时,充入足够的氧气。氧弹放入装有一定量水的内桶中,盖好外桶盖。以电控部分各开关控制搅拌并实现燃烧点火,用热敏电阻作为测温元件,用电子自动平衡记录仪连续记录内桶水温度的变化。 当温度变化不大时,可以认为热敏电阻阻值变化与温度变化成正比;当阻值变化不大时,电桥的不平衡电势U 与阻值变化成正比。所以U ∞?T 由于U 与记录仪的记录曲线峰高?h 成正比,故 ?T=a ?h (2) 式中a 为比例常数。设系统(包括所有内水桶中的物质)的热容C 为常数,则当某样品连同辅助物质棉线、金属丝燃烧后,下式成立: B c B B m U C T Ca h K h M ??=?=?=?∑ (3) 式中:c B U ?--------物质B 的摩尔燃烧内能变,J ·mol -1 B m ---------物质B 的质量 ,kg B M ---------物质B 的摩尔质量 ,kg ·mol -1 C-----------系统热容,也称能当量或水当量 J ·K -1 K-----------仪器常数,J ·mm -1 h ?---------记录仪记录曲线峰高, mm 先燃烧已知燃烧焓的物质(如苯甲酸),标定仪器常数K ,再燃烧未知物质,便可由上式计算出摩尔燃烧内能变。 2 实验操作 2.1 实验药品、仪器型号及测试装置示意图 实验仪器: GR3500型弹式量热计1套; 热敏电阻1支(约2k Ω); 大学化学实验计算机接口; 温度计1支; 2000ml ,1000ml 容量瓶各1个; 3000ml 装水盆1个; 镊子1把。 压片机、镍丝、棉线、万用表、台秤、分析天平、剪刀、尺子、氧气瓶功用。
原电池电动势的测定与应用物化实验报告
原电池电动势的测定及热力学函数的测定 一、实验目的 1) 掌握电位差计的测量原理和测量电池电动势的方法; 2) 掌握电动势法测定化学反应热力学函数变化值的有关原理和方法; 3) 加深对可逆电池,可逆电极、盐桥等概念的理解; 4) 了解可逆电池电动势测定的应用; 5) 根据可逆热力学体系的要求设计可逆电池,测定其在不同温度下的电动势值,计算电池 反应的热力学函数△G 、△S 、△H 。 二、实验原理 1.用对消法测定原电池电动势: 原电池电动势不能能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生生极化,结果使电极偏离平衡状态。另外,电池本身有内阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流通过电池的情况下进行,因此,采用对消法。对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。 2.电池电动势测定原理: Hg | Hg 2Cl 2(s) | KCl( 饱和 ) | | AgNO 3 (0.02 mol/L) | Ag 根据电极电位的能斯特公式,正极银电极的电极电位: 其中)25(00097.0799.0Ag /Ag --=+ t ?;而+ ++-=Ag Ag /Ag Ag /Ag 1 ln a F RT ?? 负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式: φ饱和甘汞 = 0.2415 - 0.00065(t – 25) 而电池电动势 饱和甘汞理论—??+=Ag /Ag E ;可以算出该电池电动势的理论值。与测定值 比较即可。 3.电动势法测定化学反应的△G 、△H 和△S : 如果原电池内进行的化学反应是可逆的,且电池在可逆条件下工作,则此电池反应在定温定
燃烧热的测定实验报告
浙江万里学院生物与环境学院化学工程实验技术实验报告 实验名称:燃烧热的测定
一、 实验预习(30分) 1. 实验装置预习(10分)_____年____月____日 指导教师______(签字)成绩 2. 实验仿真预习(10分)_____年____月____日 指导教师______(签字)成绩 3. 预习报告(10分) 指导教师______(签字)成绩 (1) 实验目的 1.用氧弹量热计测定蔗糖的燃烧热。 2.掌握恒压燃烧热与恒容燃烧热的概念及两者关系。 3.了解氧弹量热计的主要结构功能与作用;掌握氧弹量热计的实验操作技术。 4.学会用雷诺图解法校正温度变化。 (2) 实验原理 标准燃烧热的定义是:在温度T 、参加反应各物质均处标准态下,一摩尔β相的物质B 在纯氧中完全燃烧时所放出的热量。所谓完全燃烧,即组成反应物的各元素,在经过燃烧反应后,必须呈显本元素的最高化合价。如C 经燃烧反应后,变成CO 不能认为是完全燃烧。只有在变成CO 2时,方可认为是完全燃烧。同时还必须指出,反应物和生成物在指定的温度下都属于标准态。如苯甲酸在298.15K 时的燃烧反应过程为: (液)(气)(气)(固)O H CO O COOH H C 22 256372 15 +?+ 由热力学第一定律,恒容过程的热效应Q v ,即ΔU 。恒压过程的热效应Q p ,即ΔH 。它们之间的相互关系如下: nRT Q Q V P ?+= (1) 或nRT U H ?+?=? (2) 其中Δn 为反前后气态物质的物质的量之差。R 为气体常数。T 为反应的绝对温度。本实验通过测定蔗糖完全燃烧时的恒容燃烧热,然后再计算出蔗糖的恒压燃烧ΔH 。在计算蔗糖的恒压
乙醇脱氢酶(ADH)活性检测试剂盒说明书 紫外分光光度法
乙醇脱氢酶(ADH)活性检测试剂盒说明书紫外分光光度法 货号:BC1080 规格:50T/48S 产品内容: 提取液:液体50mL×1瓶,4℃保存。 试剂一:液体40mL×1瓶,4℃保存。临用前把试剂二转移到试剂一中,分装保存于-20℃。 试剂二:粉剂×1瓶,-20℃保存。 试剂三:液体5mL×1瓶,4℃保存。 产品说明: ADH是生物体内短链醇代谢的关键酶,催化乙醇与乙醛可逆转换,在很多生理过程中起着重要作用。哺乳动物ADH主要在肝脏生成,肝脏损伤导致ADH释放到血清中。血清ADH活性高低反映了肝功能是否异常。 ADH催化NADH还原乙醛生成乙醇和NAD+,NADH在340nm处有吸收峰,而NAD+没有;测定340nm吸光度下降速率,来计算ADH活性。 自备仪器和用品: 研钵、冰、低温离心机、紫外分光光度计、1mL石英比色皿、可调式移液器和蒸馏水。 操作步骤: 一、粗酶液提取: 1、组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提 取液)进行冰浴匀浆。16000g,4℃离心20min,取上清置冰上待测。 2、细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞 加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);16000g,4℃离心20min,取上清液置冰上待测。 3、血清等液体:直接测定。 二、ADH测定操作:
1.分光光度计预热30min,调节波长到340nm,蒸馏水调零。 2.试剂一在25℃水浴中保温30min以上。 3.空白管:在1mL石英比色皿中依次加入100μL蒸馏水、800μL试剂一和100μL试剂三,迅速混匀后于 340nm测定吸光值变化,分别记录15s和75s时吸光值,分别记为A1和A2。△A空白管=A1-A2。空白管只需做1~2个。 4.测定管:在1mL石英比色皿中依次加入100μL上清液、800μL试剂一和100μL试剂三,迅速混匀后于 340nm测定吸光值变化,分别记录15s和75s时吸光值,分别记为A3和A4。△A测定管=A3-A4。 三、ADH活性计算: (1)按照蛋白浓度计算 活性单位定义:25℃中每毫克蛋白每分钟氧化1μmol NADH为1个酶活单位。 ADH(μmol/min/mg prot)=[(△A测定管–△A空白管)÷ε÷d×V反总×106]÷(Cpr×V样)÷T =1.61×(△A测定管–△A空白管)÷Cpr (2)按照样本质量计算 活性单位定义:25℃中每克组织每分钟氧化1μmolNADH为1个酶活单位。 ADH(μmol/min/g)=[(△A测定管–△A空白管)÷ε÷d×V反总×106]÷(W×V样÷V样总)÷T =1.61×(△A测定管–△A空白管)÷W (3)按细胞数量计算 活性单位定义:25℃中每104个细胞每分钟氧化1μmolNADH为1个酶活单位。 ADH(μmol/min/104cell)=[(△A测定管–△A空白管)÷ε÷d×V反总×106]÷(细胞数量×V样÷V样总)÷T=1.61×(△A测定管–△A空白管)÷细胞数量 (4)按液体体积计算 活性单位定义:25℃中每毫升样品每分钟氧化1μmol NADH为1个酶活单位。 ADH(μmol/min/mL)=[(△A测定管–△A空白管)÷ε÷d×V反总×106]÷V样÷T =1.61×(△A测定管–△A空白管) ε:NADH摩尔消光系数,6.22×103L/mol/cm;d:比色皿光径,1cm;
原电池电动势的测定实验报告
实验九原电池电动势的测定及应用 一、实验目的 1.测定Cu-Zn电池的电动势和Cu、Zn电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC-Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=-(9-1) 式中G ?是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为965001 ?);E为电池的电动势。所以测出该电池的电动势E后,进而 C mol- 又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计 测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22()()2Zn Zn s Zn a e ++ - + 正极起还原反应: 22()2()C u C u a e C u s + +- + 电池总反应为: 2222()()()()C u Zn Zn s C u a Zn a C u s ++++ ++ 电池反应的吉布斯自由能变化值为: 22ln C u Zn Zn C u a a G G RT a a ++?=?- (9-2) 上述式中G ? 为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221C u Zn a a + +==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn C u a R T E E nF a ++ =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1ln 2C u C u C u RT F a ??+ ++=- (9-6) 22,1ln 2Zn Zn Zn RT F a ??+ + -=- (9-7) 式中2,Cu Cu ?+ 和2,Zn Zn ?+ 是当221C u Zn a a + +==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
燃烧热的测定实验报告
实验二 燃烧热的测定 一、目的要求 1.用氧弹量热计测定萘的燃烧热。 2.了解氧弹量热计的原理、构造及使用方法。 二、实验原理 1摩尔物质完全氧化时的反应热称为燃烧热。所谓完全氧化是指C 变为CO 2(气),H 变为H 2O(液),S 变为SO 2(气),N 变为N 2(气),如银等金属都变成为游离状态。 例如:在25℃、1.01325×105Pa 下苯甲酸的燃烧热为-3226.9kJ/mol ,反应方程式为: 1.01325105165222225C H COOH()+7O ()7CO H O Pa s g g l ??????→℃ ()+3() 3226.9kJ/mol c m H O ?=- 对于有机化合物,通常利用燃烧热的基本数据求算反应热。燃烧热可在恒容或恒压条件下测定,由热力学第一定律可知:在不做非膨胀功的情况下,恒容燃烧热V Q U =?,恒压燃烧热p Q H =?。在体积恒定的氧弹式量热计中测得的燃烧热为Q V ,而通常从手册上查得的数据为Q p ,这两者可按下列公式进行换算 ()p V Q Q RT n g =+? (2-1) 式中,Δn(g)——反应前后生成物和反应物中气体的物质的量之差; R ——气体常数; T ——反应温度,用绝对温度表示。 通常测定物质的燃烧热,是用氧弹量热计,测量的基本原理是能量守恒定律。一定量被测物质样品在氧弹中完全燃烧时,所释放的热
量使氧弹本身及其周围的介质和量热计有关附件的温度升高,测量介质在燃烧前后温度的变化值T ?,就能计算出该样品的燃烧热。 ()V W W Q Q C W C M + =+样品 21总铁丝铁丝水水(T -T ) (2-2) 式中,W 样品,M ——分别为样品的质量和摩尔质量; Q V ——为样品的恒容燃烧热; W 铁丝,铁丝Q ——引燃用的铁丝的质量和单位质量的燃烧热 (-16.69kJ g Q =?铁丝); C W 水水,——分别为水的比热容和水的质量; C 总——是量热计的总热容(氧弹、水桶每升高1K ,所需的总 热量); 21T T -——即T ?,为样品燃烧前后水温的变化值。 若每次实验时水量相等,对同一台仪器C 总不变,则(C W C +总水水)可视为定值K ,称为量热计的水当量。 水当量K 的求法是:用已知燃烧热的物质(本实验用苯甲酸)放在量热计中燃烧,测其始末温度,求出T ?,便可据式2-2求出K 。 三、仪器和药品 1.仪器 SHR-15氧弹量热计1台;SWC-ⅡD 精密温度温差仪1台;压片机 1台;充氧器1台;氧气钢瓶1个。部分实验仪器如图2.1和图2.2所示。
乙醛脱氢酶(ALDH)活性检测试剂盒说明书微量法
乙醛脱氢酶(ALDH)活性检测试剂盒说明书微量法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。 货号:BC0755 规格:100T/96S 产品内容: 提取液:液体100mL×1瓶,4℃保存。 试剂一:液体10mL×1瓶,4℃保存。 试剂二:粉剂40mg×1瓶,-20℃避光保存。临用前加入3mL蒸馏水溶解,-20℃分装保存;或者按比例现用现配。 试剂三:液体0.5mL×1支,4℃避光保存。 试剂四:液体1mL×1支,4℃保存。 试剂五:液体2mL×1瓶,4℃保存。 产品说明: 乙醛脱氢酶(EC 1.2.1.10)是醛脱氢酶的一种,广泛存在于各种动物、植物和微生物体内。在辅酶I 的存在下,它催化乙醇在内的某些一级或二级醇、醛或酮的脱氢反应。在人类和许多动物体内,线粒体乙醛脱氢酶能把对生物体有害的醇类转化,所以在细胞解毒研究中乙醛脱氢酶受到高度关注;同时,乙醛脱氢酶在分子生物学以及相关疾病的检测方面有较广泛的研究应用。 乙醛脱氢酶催化乙醛和NAD+转化为乙酸和NADH,利用NADH在340nm处吸光值的变化即可计算得到乙醛脱氢酶的活性。 试验中所需的仪器和试剂: 紫外分光光度计/酶标仪、台式离心机、水浴锅、微量石英比色皿/96孔UV板、可调式移液枪、研钵/匀浆器、冰和蒸馏水。 操作步骤: 一、粗酶液提取:
组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后,10000g,4℃,离心20min。 细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL 提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后10000g,4℃,离心20min,取上清置于冰上待测。 液体:直接检测。 二、测定步骤: 1、紫外分光光度计/酶标仪预热30min以上,调节波长至340nm,蒸馏水调零。 2、将试剂一37℃(哺乳动物)或25℃(其他物种)预热15min。 3、操作表: 试剂名称空白管测定管 样本(μL)40 蒸馏水(μL)10060 试剂一(μL)6060 试剂二(μL)2020 试剂三(μL)44 试剂四(μL)66 试剂五(μL)1010 在微量石英比色皿/96孔UV板中分别加入上述试剂,充分混匀后于340nm处测定30s时的吸光值A1,迅速置于37℃(哺乳动物)或25℃(其他物种)水浴或培养箱1min(酶标仪有控温功能可将温度调至37℃或25℃),拿出迅速擦干测定90s时的吸光值A2,计算△A测定管=A2测定-A1测定,△A空白管=A2空白-A1空白,△A=△A测定管-△A空白管。空白管只需做一次。 三、ALDH酶活计算 1、按微量石英比色皿计算: (1)按蛋白浓度计算 酶活定义:每毫克蛋白每分钟催化还原1nmol NAD+的酶量为1个酶活单位。 ALDH酶活(U/mg prot)=△A÷(ε×d)×109×V反总÷(V样×Crp)÷T=804×△A÷Cpr (2)按样本质量计算
燃烧热的测定 实验报告
燃烧热的测定 一、实验目的 ●使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并 由此求算其摩尔燃烧热。 ●了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的 使用方法,熟悉贝克曼温度计的调节和使用方法 ●掌握恒容燃烧热和恒压燃烧热的差异和相互换算 二、实验原理 摩尔燃烧焓?c H m 恒容燃烧热Q V ?r H m = Q p ?r U m = Q V 对于单位燃烧反应,气相视为理想气体 ?c H m = Q V +∑νB RT=Q V +△n(g)RT 氧弹中 放热(样品、点火丝)=吸热(水、氧弹、量热计、温度计) 待测物质 QV-摩尔恒容燃烧热Mx-摩尔质量 ε-点火丝热值bx-所耗点火丝质量q-助燃棉线热值cx-所耗棉线质量 K-氧弹量热计常数?Tx-体系温度改变值
三、仪器及设备 标准物质:苯甲酸待测物质:萘 氧弹式量热计 1-恒热夹套2-氧弹3-量热容器4-绝热垫片5-隔热盖盖板6-马达7,10-搅拌器8-伯克曼温度计9-读数放大镜11-振动器12-温度计
四、实验步骤 1.量热计常数K的测定 (1) 苯甲酸约1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放置样片前后质量W1和W2 (2)把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线 (3) 盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa为止 (4)把氧弹放入量热容器中,加入3000ml水 (5) 调节贝克曼温度计,水银球应在氧弹高度约1/2处 (6) 接好电路,计时开关指向“1分”,点火开关到向“振动”,开启电源。约10min后,若温度变化均匀,开始读取温度。读数前5s振动器自动振动,两次振动间隔1min,每次振动结束读数。 (7)在第10min读数后按下“点火”开关,同时将计时开关倒向“半分”,点火指示灯亮。加大点火电流使点火指示灯熄灭,样品燃烧。灯灭时读取温度。 (8)温度变化率降为0.05°C·min-1后,改为1min计时,在记录温度读数至少10min,关闭电源。先取出贝克曼温度计,再取氧弹,旋松放气口排除废气。 (9)称量剩余点火丝质量。清洗氧弹内部及坩埚。 实验步骤 2. 萘的恒容燃烧热的测定 取萘0.6g压片,重复上述步骤进行实验,记录燃烧过程中温度
土壤脱氢酶活性的测定
土壤脱氢酶活性的测定 一、实验原理 脱氢酶的正式命名是AH:B氧化还原酶,广泛存在于动植物组织和微生物细胞内,它能酶促一定的基质中脱出氢而进行氧化作用。脱氢酶的种类因电子供给体和接受体的特异性而有不同。单位时间内脱氢酶活化氢的能力表现为它的酶活性。通过测定土壤中微生物的脱氢酶活性,可以了解微生物对土壤中有机物的氧化分解能力,即土壤酶的活性。 已知受氢体可接受脱氢酶脱出的氢原子,根据接收氢原子的量可以判断脱氢酶的活性。如无色的氯化三苯基四氮唑(TTC,俗称红四唑)接受氢后变成红色的三苯基甲瓒(TF),根据产生红色的色度进行比色定量分析,就可以判断脱氢酶的活性。通常,吸光度越大(红色越深),脱氢酶活性越大。 二、实验材料、试剂和仪器 1.材料:过0.9mm孔径筛的土壤样品,8g 2.试剂:0.36%Na2SO3溶液,15ml Tris-HCl缓冲液(PH=7.6),45ml 0.4%TTC,7.6ml Na2S2O4,十几粒 甲醛,10ml 丙酮,20ml 3.仪器:50ml具塞比色管,6只 比色管架,1只 1~5ml移液枪,1只(枪头3个) 100~1000ul移液枪1只(枪头1个) 药匙1个 水浴锅1个 分光光度计1台 分析天平1台 离心管4只 培养箱1台
离心机1台 三、实验步骤 1.标准曲线的绘制 (1)按下表配制系列浓度的TTC标准溶液。 (2)显色。 用药匙向每只比色管中各加入少许连二亚硫酸钠(Na2S2O4),混匀,使TTC 全部还原为红色的TF。用1~5ml移液枪向各管滴加1ml甲醛终止反应,摇匀后再加入2ml丙酮震荡摇匀,37℃水浴10min。 (3)测定吸光度,绘制标准曲线。 在485nm波长下测定各管溶液的吸光度A,并以A为纵坐标,TTC浓度为横坐标,绘制出TTC标准曲线。 2.土壤脱氢酶活性的测定 (1)培养并显色(此步骤由助教预先完成)。 首先,按下表向四只离心管中分别加入以下物质 然后,将以上四只离心管避光,37℃保温培养12~24h。 (2)培养结束后,用1~5ml可调式移液枪向各管分别加入1ml甲醛终止反应,
有机物燃烧焓的测定。实验报告
有机物燃烧焓的测定 一.实验目的 1.明确燃烧焓的定义,了解恒压热效应与恒容热效应的关系。 2.掌握有关热化学实验的一般知识和技术。 3.用氧弹式量热计测定有机物的燃烧焓。 二.实验原理 热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m 。通常,C 、H 等元素的燃烧产物分别为CO 2(g)、H 2O(l)等。由于上述条件下ΔH=Q p ,因此ΔC H m 也就是该物质燃烧反应的等压热效应Q p,m 。 在适当的条件下,许多有机物都能迅速而完全地进行氧化反应,这就为准确测定它们的燃烧焓创造了有利条件。 在实际测量中,燃烧反应常在恒容条件下进行,如在弹式量热计中进行,这样直接测得的是反应的恒容热效应Q V (即燃烧反应的热力学能变ΔC U )。若将应系统中的气体物质视为理想气体,根据热力学推导可得ΔC H m 和ΔC U m 的关系为: )(g RT U H B B m c m c ν∑+?=? 或 )(,,g RT Q Q B B m v m p ν∑== (1) 式中,T 为反应温度(K);ΔC H m 为摩尔燃烧焓(J·mol -1);ΔC U m 为摩尔燃烧热力学能变(J·mol -1 );v B (g)为燃烧反应方程中各气体物质的化学计量数,规定生产物取正值,反应物取负值。 通过实验测得Q V,m (J·mol -1 )值,根据上式就可计算出Q p,m (J·mol -1 ),即燃烧焓的值ΔC H m 。 本实验是用氧弹式量热计进行萘的燃烧焓的测定。量热计结构如图1所示,氧弹结构如图2所示。 实 验中,设质量为m a (g )的待测物质(恒容燃烧热为Q v,m )和质量为m b (g )的点火丝(恒容燃烧热为q ,J·g -1 )在氧弹中燃烧,放出的热可使质量为w m 的水(比热容为c w ,J·K -1 ·g -1 )及量热器本身(热容为C m ,J·K -1)的温度由T 1升高到T 2,则根据能量守恒定律可得到热平衡关系 )()]().[(1212,T T K T T w c C m q M m Q m w m b a m -?=-?+-=?+? ν (2) 式中,M 为该待测物的摩尔质量;规定系统放热时Q 取负数;K= -( C m +c w · w m ),同一套仪器、当内筒中的水量一定时,K 值恒定,称K 为仪器常数或水当量(J·K -1 ),常用已知燃烧热值Q v 的苯甲酸来测定。求
土壤脱氢酶(S-DHA)活性检测试剂盒说明书 可见分光光度法
土壤脱氢酶(S-DHA)活性检测试剂盒说明书可见分光光度法 注意:正式测定前务必取2-3个预期差异较大的样本做预测定 货号:BC0390 规格:50T/24S 产品简介: 土壤脱氢酶(Soil dehydrogenase,sDHA)的活性可以反映土壤体系内活性微生物量以及其对有机物的降解活性,可以作为土壤微生物的降解性能指标。 氢受体2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyl Tetrazolium Chloride,TTC)在细胞呼吸过程中接受氢以后,被还原为三苯基甲臜(Triphenyl Formazone,TF),TF呈现红色,在波长485nm处有最大吸收峰,采用分光光度法于485nm测定其吸光值,即得土壤脱氢酶活性。 试验中所需的仪器和试剂: 筛子、天平、恒温培养箱或水浴锅、低温离心机、可见分光光度计、玻璃比色皿,冰、蒸馏水、丙酮(不允许快递,请用户自备)。 产品内容: 试剂一:粉剂×1瓶,使用前加30ml水溶解,4℃避光保存(尽量现配现用)。 试剂二:液体50ml×1瓶,4℃保存。 试剂三:丙酮,自备。 操作步骤: 一、样本前处理: 1.土壤样品:准确称取过40目筛的新鲜土壤样品约0.1g(以保证TTC与土壤颗粒充分接触)。 2.污泥样品:污泥用蒸馏水洗涤,12000rpm,25℃,离心10min,弃上清,反复3-4次。 二、测定操作: 对照管测定管 样品(g)0.10.1
试剂一(ml) 0.5试剂二(ml)10.5 充分混匀,37℃,暗培养6h,取出后立即冰浴5min 试剂三(ml)0.50.5 反复震荡数次,37℃保温10min,12000rpm,4℃,离心5min,取上清1ml 于1ml 玻璃比色皿, 分光光度计提前30分钟预热,蒸馏水调零,测定对照管和测定管,计算△A。 脱氢酶活力的计算: 酶活单位定义:在37℃时,每克样品每小时使每ml 反应体系OD 值每增加0.01为一个酶活单位。计算公式:sDHA 活性(U/g)=01.0△A ÷培养时间(6h)÷样品质量(0.1g)×V 反总(1.5ml) =250×A 485 注意事项: 1. 配制好的试剂一避光保存于4℃,最好在一周内使用,若出现红色,则不能使用。2. 试剂三易挥发,有毒,为了您的健康,请穿实验服,戴口罩,戴乳胶手套操作。3. 反应完成后立即冰浴以终止反应。4. 如果测定出来的吸光值较大,减少样品用量再进行测定,若吸光值过小则延长培养时间。5.试剂盒2-8℃保存。
相关文档
- 琥珀酸脱氢酶活性的测定
- 乙醇脱氢酶(ADH)活性检测试剂盒说明书 紫外分光光度法
- TTC—脱氢酶活性测定法的改进
- 脱氢酶活性法
- 土壤脱氢酶测定-TTC还原法
- 土壤脱氢酶(S-DHA)活性检测试剂盒说明书 可见分光光度法
- 脱氢酶活性检测方法
- 琥珀酸脱氢酶的提取与活力测定的研究进展
- 植物脱氢酶(PDHA)活性检测试剂盒说明书 微量法
- 实验6 乳酸脱氢酶的活性测定
- 脱氢酶的测定
- .脱氢酶活性测定
- 土壤脱氢酶活性的测定
- 乙醇脱氢酶(ADH)活性测定试剂盒说明书
- 乳酸脱氢酶活力测定
- 脱氢酶活性的测定
- 细菌脱氢酶活性的测定
- 葡萄糖脱氢酶(GCDH)活性检测试剂盒说明书 紫外分光光度法
- 脱氢酶活性测定实验报告
- 乙醛脱氢酶(ALDH)活性检测试剂盒说明书微量法
最新文档
- 部编版】统编教材五年级语文上册第16课《太阳》说课稿
- 幂等矩阵的性质及应用(定稿)
- 矩阵论_最小多项式_JORDAN式子
- 高等代数论文
- 幂等矩阵的性质研究
- N阶矩阵高次幂的求法及应用.
- 幂等矩阵的行列式
- 广义m对合矩阵和(m,l)幂等矩阵的充要条件及应用
- 幂等矩阵概念
- 矩阵n次方通用解法
- ae的n次方矩阵
- 矩阵幂次方计算
- e的矩阵指数的计算方法
- 幂等矩阵的研究现状与意义
- 化工过程开发与设计.ppt.Convertor
- 初中化学第八单元金属与金属材料(复习)教学设计
- 实验活动4金属的物理性质和某些化学性质.ppt
- 9.2化学合成材料教案
- PVC的物化性质
- 高2021届高2018级高三化学一轮复习衡中金榜化学配套PPT课件学案1-39
