化学必修1作业参考答案

化学必修1作业参考答案
第一章从实验学化学
第一节
作业一
1. C
2. C
3. D
4. D
5. C
6. D
7. C
8. B
9. B
10. 略
11.(1)不能超过酒精灯容积的1/3 ⑵用火柴点燃⑶沿着漏斗向酒精灯内添加酒精
⑷用外焰加热(5)用灯帽盖灭
12. (1)通氢气停止加热(2)导管酒精灯倒吸(3)水浓硫酸
13. ①钠浮在水面,熔化为光亮的小球②钠在水面上转动③发出响声④有气泡产生⑤溶液变为红色
作业二
1. C
2. C
3. B
4. B
5. D
6. A
7. 分离是把混合物中的各种物质分开的过程。物质的提纯:是指将某物质中的杂质,采用物理或化学方法除掉的过程。它和
分离的主要区别在于除掉后的杂质可以不进行恢复。
8. 铁架台、铁圈、漏斗、玻璃棒、烧杯、滤纸
9.(1)在上层清液中(或取少量上层清液置于小试管中),滴加沉淀剂,如果不再产生沉淀,说明沉淀完全。(2)向漏斗里注
入蒸馏水,使水面没过沉淀物,等水流完后,重复操作2~3次。
10.(1)取溶液加BaCl2,有沉淀则有SO42-(2)Ca2+(3)③②①⑤④(或②③①⑤④)
(4)溶解时:加速固体的溶解过滤时:引流蒸发时:使液体受热均匀
作业三
1. A
2.C
3.D
4.B
5.B
6.C
7. 萃取、加热分解、过滤、结晶、蒸馏、分液、升华、洗气、杂质转化法等
8. 铁架台、铁圈、石棉网、酒精灯、蒸馏烧瓶、温度计、冷凝管、锥形瓶、牛角管
9.(1)C、B、D、H(2)漏斗要紧贴烧杯、打开玻璃塞、开始放液体可快,然后慢慢;平衡压力便于液体流出(3)CCl4不溶
于水、碘在CCl4中的溶解度远大于碘在水中的溶解度、CCl4的密度大于水。
10. ①a、制气体②d、过滤③ b、分液④c、加酒精
第二节
作业一
1. A
2.D
3.C
4.D
5.B
6.D
7.C
8.D
9. 16 g/mol 96 g/mol 172 g/mol
10. 1.34×1021
11. 5∶10∶5
12. 32
13. 0.1 mol 3.01×1023
14. 0.1 mol 1.2×1023
作业二
1. A
2. D
3. B
4. A
5. B
6. C
7. A
8. C
9. n=V/Vm10. 22.4 11. 不同相同12. 7:11
13.(1)0.2 g (2)2.24 L (3)0.1 mol 0.1 mol
作业三
1. A
2. D
3. C
4. B
5. C
6. D
7. 0.1 0.2 8. 31.25
9.(1)①②④③⑤ (2)天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管。(3)偏高(4)偏低偏低无影响。10. 426 g 11. 82.9 mL
单元作业
1. D
2. A
3. B
4. D
5. D
6. C
7. A
8. C
9.⑴m/M ⑵2m6.02×1023/M ⑶22.4 m/M ⑷100m/(m+100)% ⑸m/MV
10. (1)②⑦⑧(2)5.4mL ①(3)500 引流烧杯 1 cm~2 cm 胶头滴管凹面正好跟刻度相平(4)①②③④⑥⑦
①②⑦
11. 0.2 mo1 1.79ρmol/L 12. 6471 g/mol
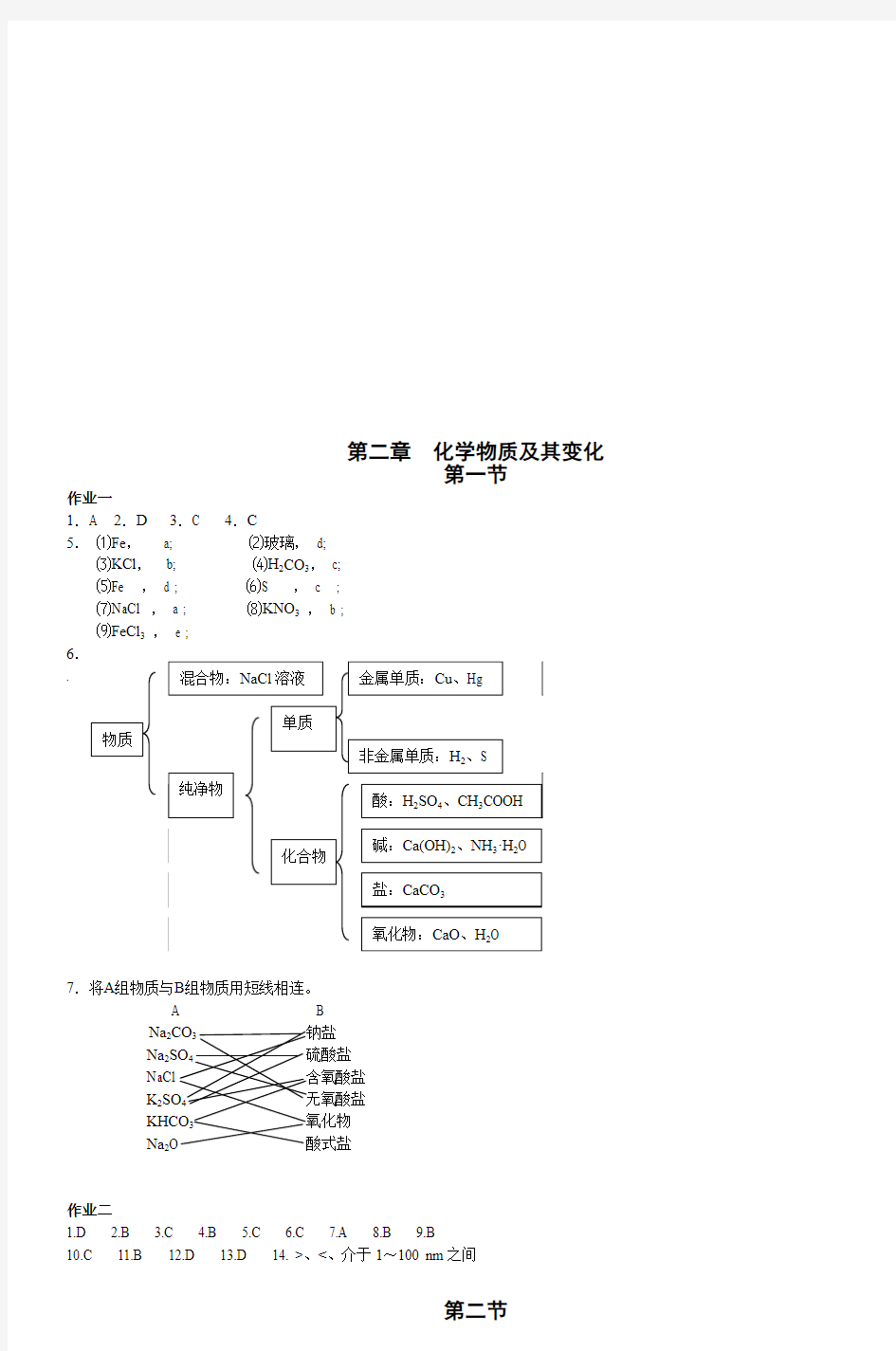
第二章 化学物质及其变化
第一节
作业一
1.A 2.D 3.C 4.C
5. ⑴Fe , a; ⑵玻璃, d;
⑶KCl , b; ⑷H 2CO 3, c; ⑸Fe , d ; ⑹S , c ; ⑺NaCl , a ; ⑻KNO 3 , b ; ⑼FeCl 3 , e ; 6. .
7.将A 组物质与B 组物质用短线相连。
A B
Na 2
CO 3 钠盐
Na 2SO 4 硫酸盐 NaCl 含氧酸盐 K 2SO 4 无氧酸盐 KHCO 3 氧化物 Na 2O 酸式盐
作业二
1.D
2.B
3.C
4.B
5.C
6.C
7.A
8.B
9.B
10.C 11.B 12.D 13.D 14. >、<、介于1~100 nm 之间
第二节
作业一
1.B
2.B
3.C
4.D
5.C
6.A
7.C
8.在水溶液中或熔融状态下能导电的化合物A、C、G、H
9.酸:电离产生的阳离子全部为氢离子的化合物
碱:电离产生的阴离子全部为氢氧根离子的化合物
盐:电离产生金属阳离子(或铵离子)和酸根离子的化合物
10.(1)H2SO4=2H++SO42― (2)HNO3=H++NO3―
(3)Ca(OH)2= Ca 2++2OH―(4)CuCl2=Cu2++2Cl―
(5)Al2(SO4)3=2 Al 3++3 SO42―
11.固体氯化钠中尽管有阴阳离子,但没有处于自由移动状态,溶于水或熔融状态下,离子处于自由移动状态;自由移动的电子;自由移动的阴阳离子;减弱;增强。
作业二
1.A 2.D 3.D 4.C 5.A 6.D
7.(1) CuSO4 +2NaOH = C u(O H)2↓+Na2SO4 (2) NaOH +HCl = H2O +NaCl
(3) 2 HCl +CaCO3 = CaCl2 +H2O +CO2↑ (4) 2 HCI +Na2CO3 = H2O +CO2↑+2NaCl
(5) CuCl2 +Fe = FeCl2 +Cu
8.(1)6H++Fe2O3 = 2Fe3++3H2O (2)CO32― +2H+= H2O +CO2↑
(3)Cu2++SO42― +Ba2++2 OH―= C u(O H)2↓ +Ba SO4↓
(4)Ca2++2OH― +CO2 = CaCO3↓+H2O(5)C u(O H)2 +2H+= Cu2++2H2O
9.1)CO32―;Ba(NO3)2Ba2+ + CO32― = BaCO3↓
(2)OH-;Fe(NO3)3Fe3+ + 3OH― = Fe(OH)3↓
(3)Cl-;AgNO3Ag+ + Cl― = AgCl ↓
10.2 2
11.⑴2H++SO42―+Ba2++2OH―=BaSO4↓+2H2O ⑵Ba2++SO42―=BaSO4↓
第三节
作业一
1.B 2.A 3.C 4.B 5.B 6.C 7.A 8.D 9.D 10. A;BC;FH;DE;ACGH 11.(略)
作业二
1.A、B 2.B 3.D 4.D 5.C 6.B C A D 7.C 8.A 9.K2Cr2O7,HCl ,Cl ,Cr ,Cl2,CrCl3,还原性和酸性。
10.Fe3+、Na+,降低,氧化,氧化;Fe、Cl-;失去,氧化,升高。
Fe2+、Cl2。
单元作业
1.D 2.B 3.A 4.C 5.D 6.B 7.A 8.C 9.B 10.C
11.⑴④⑧⑩⑵①③⑤⑧⑶②⑥⑦
12.H+ ,Zn2+ ,SO42―,Zn+ 2H+= Zn2++H2↑↑
13.S, N, C, KNO3 , S ,C
14.A.Na2CO3, B.Na2SO4,C.H2SO4,D.BaCl2
2H+ +CO32― =H2O +CO2↑ ;CO32― +Ba2+ =BaCO3 ↓
或(A.H2SO4 B.Na2SO4 C.Na2CO3D.BaCl2
2H+ +CO32― =H2O +CO2↑ SO42― +Ba2+ =BaSO4↓)
失2e-被氧化
15. (1)2 FeCl 3+Fe=3FeCl 2 FeCl 3 是氧化剂 Fe 是还原剂
得 2e -
被还原
失2e -
22SO 3+3H 2O S 既是氧化剂又是还原剂
得 4e - 被还原
16.0.09 mol 、0.01 mol
第三章 金属及其化合物
第一节
11.用镊子取出钠块,用滤纸擦净表面上的煤油,在玻璃片上用小刀切去表面的氧化膜,再切下一小粒备用,余下的钠全部放回试剂瓶里的煤油中。
12.钠很软 银白色 金属光泽 暗 Na 2O 4Na + O 2 == 2Na 2O 13.①钠的密度比水的密度小;
②钠非常活泼,钠与水反应放热,钠的熔点低 ③反应有气体生成,气体推动小球游动; ④反应有碱生成
⑤2Na+2OH -=2Na ++2OH -+H 2↑ 14.(1)
c
b a b
-+
(2)吸收H 2中所含的水蒸气
(3)偏小;若不 CaCl 2干燥,H 2将带走部分水蒸气,使测得的H 2质量偏大,使测定的相当原子质量偏小。 15.(1)2Na+2H +==2Na + + H 2↑ 2Na + 2H 2O == 2Na + + 2OH -+ H 2↑ (2)1.12L
(3)2.3%或0.023
11.Na 2CO 3 4Na + O 2 == 2Na 2O ; Na 2O + H 2O == 2NaOH 12.①试管内壁有无色液滴
②干燥气体(或吸收H 2O )
③2Na 2O 2 + 2CO 2 == 2Na 2CO 3 + O 2
④石灰水变浑浊, CO 2 + Ca (OH )2 == CaCO 3↓ + H 2O , ⑤O 2
13.①普通铁粉;提供水蒸气;安全瓶; H 2
②吸收H 2中的水蒸气和氯化氢; 6mol/L 盐酸 ③A 、B 、E
④Fe 3O 4 + 4H 2 == 3Fe+ 4H 2O ⑤检验H 2的纯度;点燃H 2
第二节
作业一
11.(1)减少 增多 (2)增多 减少 (3)减少 减少
12.Na 2CO 3或NaHCO 3,或Na 2O 2
13.NaHCO 3;Na 2CO 3,NaOH ,Na 2O 2 (2)②③;Na 2O 2 14.(1)各取少许溶液,分别滴入BaCl 2溶液,能生成沉淀的原溶液为Na 2CO 3和Na 2SO 4;无沉淀生成的原溶液为NaHCO 3和
NaCl 。离子方程式为:
CO 3- + Ba 2+ == BaCO 3↓ SO 42- + Ba 2+ == BaSO 4↓
(2)在沉淀中分别滴入稀盐酸,能溶解的是BaCO 3,原溶液为Na 2CO 3溶液,不溶解的BaSO 4,原溶液为Na 2SO 4溶液。离
子方程式:
BaCO 3 + 2H + == Ba 2+ + H 2O + CO 2↑
(3)再向无沉淀的两种溶液中加稀盐酸,产生气体的原溶液为NaHCO 3溶液,无现象的原溶液为NaCl 。离子方程式:
HCO 3- + H + == H 2O + CO 2↑
15.58%
作业二
22 设溶液的体积均为V 1 4 C (Al 3+)V 0.2mol/LV
L
mol Al c LV mol V Al c /05.0)(/2.04
)(133==
++ 其次根据溶液的电中性原理:
3c (Al 3+) + c (K +) == 2c (SO 42-) 3?0.05mol/L + c (K +) == 2 ? 0.2mol/L C (K +)==0.25mol/L 12.V 1=1500mL m 18.55g V 2=2000mL m 2=9.32g
11.(1)加热 2NaHCO 3
△
Na 2CO 3
+ CO 2↑+ H 2O (2)通过量CO 2;CO 32- + CO 2 + H 2O == 2HCO 3- (3)Fe 粉 2Fe 3+ + Fe == 3Fe 2+
(4)氯气 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl -
(5)NaOH 溶液 Fe 3+ + 3OH - == Fe (OH )3↓ (6)NaOH 溶液 Al 2O 3 + 2OH - == 2AlO 2- + H 2O 12.(1)FeCl 2 KCl
(2)4Fe (OH )2 + O 2 + 2H 2O == 4Fe (OH )3 (3)2Fe 3+ + Fe == 3Fe 2+ 13.(1)Fe (OH )3 0.06mol (2)0?X≤0.6
第三节
11.合金
12.弱+4
13.(1)HCl ;H2NaAlO2Fe(OH)3
(2)2FeCl2 + Cl2 == 2FeCl3;2FeCl3 + Fe == 3FeCl2
Al(OH)3 + NaOH == NaAlO2 + 2H2O
14.(1)Cu—Zn合金;(3)0.1mol (4)35%
[提示]:前两次加入10mL盐酸生成的氢气在标准状况下的体积均为896mL,而第三次同样的10mL盐酸生成的氢气在标准状况下的体积却为448mL,说明盐酸已经过量,合金中的Zn已经完全溶解,可以根据氢起的量计算出合金中Zn的质量。
第三章
11.向所得淡黄色粉末中加少量水,用带火星的木条检验产生的气体,木条复燃,证明有O2产生,向所得溶液中滴入几滴酚酞试液,溶液变红,证明有碱产生,即可证明是Na2O2而非Na2O。
12.(1)盐酸(或硫酸或硝酸)
CO32- + 2H+ == CO2↑ + H2O;HCO3- + H+ == CO2↑ + H2O
(2)澄清石灰水;白色浑浊
(3)分别取Na2CO3和NaHCO3粉末少量于烧杯中,加少量水溶解,分别滴入CaCl2溶液,其中出现白色沉淀的是Na2CO3,无明显现象的是NaHCO3。
CO32- + Ca2+ == CaCO3↓
13.(1)红;红;红
(2)生成红褐色的沉淀;FeCl3 + 2NaOH == Fe(OH)2+ 2NaCl
4Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
生成白色的沉淀,AlCl3 + 3NaOH == Al(OH)3↓ + 3NaCl
沉淀溶解;Al(OH)3 + NaOH == NaAlO2 + 2H2O
14.(1)B A E
(2)3Fe +4H2O(g)高温Fe3O4 + 4H2
(3)黑色固体变红,右端管壁有水珠
(4)取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色
第三章
11.①干冰
②罐内放入干冰并振荡后,干冰升华,排出空气,罐内充满CO2气体。加入NaOH溶液后,CO2与NaOH反应,容器内压
强减小,造成易拉罐变瘪;
CO2 + 2OH- == CO32- + H2O
③又由于NaOH溶液不断与铝反应放出氢气,一段时间后,由使变瘪的易拉罐逐渐鼓起。2Al + 2OH- + 2H2O == 2AlO2-
+ 3H2↑
12.BaCl2 Na2SO4 Na2CO3;FeCl3 K2SO4 K2CO3;NaCl
13.(1)m(Fe)=16.8g m(Fe2O3)=32g
(2)c(H2SO4)=1mol/L
第四章非金属及其化合物
第一节
作业一
1.B ;2.C ;3.D ;4.B ;5.C ;6.C ;7.B ;8.C ;9.C ;10.D 11.略;最外层均有4个电子 12.氢氧化钠溶液
13.⑴硅;⑵光导纤维;⑶SiO 2+2OH —
=SiO 32—
+H 2O
14.答案略 作业二
1.D ;2.B ;3.B ;4.B ;5.B ;6.C ;7.A ;8.D
9.陶瓷、玻璃、水泥;抗氧化、抗腐蚀、耐高温;吸附水分的能力;催化剂 10.Al 2O 3·2SiO 2·2H 2O;Na 2O ·Al 2O 3·4SiO 2
11.SiO 2 + 2C Si + 2CO ↑;Si + 2Cl 2 SiCl 4;SiCl 4 + 2H 2 Si + 4HCl
12.答案略(如光导纤维、高温结构陶瓷、压电陶瓷等新型无机非金属材料特性、用途等正确即可。) 13.50%
第二节
作业一
1.B ;2.C .;3.D ;4.B ;5.C ;6.D ;7.A ;8.B ;9.C ;10.C 11.黄绿;强烈刺激性;很活泼;很强;钠、铁
12.Cl 2 + 2NaBr =2NaCl + Br 2;Br 2 + 2KI =2KBr + I 2;A 13.11.2 L ;0.5mol ;1 mol/L ;0.1 mol/L 作业二
1.B ;2.D ;3.A ;4.A ;5.A ;6.A ;7.A 8.⑴淀粉溶液;不变色;⑵ AC ;⑶ IO 3-
;3.01×1023
9.要点:转变为较稳定的、易贮存的物质;2Cl 2+2Ca(OH)2=CaCl 2 + Ca(ClO)2 + 2H 2O ;Ca(ClO)2 + CO 2 + H 2O =CaCO 3↓+ 2HClO (或与盐酸反应);漂白粉与空气中的水和二氧化碳反应生成的HClO 分解(2HClO 2HCl + O 2↑)故久置失效。
10.⑴ MnO 2 +4HCl(浓) MnCl 2 + 2H 2O + Cl 2↑(电子转移数和方向略);⑵ d ;⑶ 蓝色(1分);Cl 2 + 2I -
= 2Cl -
+I 2;⑷ 能;答题要点:氯气没有经过干燥,水和氯气反应生成的次氯酸可使有色布条褪色;⑸ 浓硫酸;⑹ 吸收剩余的氯气;Cl 2 + 2OH -
=ClO -
+ Cl -
+ H 2O ;⑺ 硝酸酸化的硝酸银溶液;Ag + + Cl -
= AgCl ↓。
第三节
作业一
1.D ;2.B ;3.C ;4.B ;5.A ;6.C ;7.A ;8.D
9. 小于5.6;在选煤工序中降低硫含量、开发新能源减少煤的使用、用石灰水溶液吸收SO 2、将经除杂后富集的SO 2通入NaHCO 3
溶液,将产生的CO 2用于大棚蔬菜生产,做气体肥料、种植柳杉、垂柳、臭椿等可吸收SO 2的植物等
10.⑴雨水样品里中强酸H 2SO 3 和SO 2 不断被空气中的氧气氧化生成强酸H 2SO 4 ,随时间延长c (H +)增大,pH 下降,至全部
被氧化后,溶液中形成的H 2SO 4 不会被氧化和挥发,所以pH 不再发生变化。⑵2SO 2 + 2H 2O +O 2 = 4H + + 2SO 42-
11.⑴ 1、3、4、5、3;⑵ ①③、①④、②⑥;⑶ D ;装置内壁上有淡黄色的固体析出和液滴生成;C ;溴水褪色;⑷ 连接
盛有NaOH 的C 装置3。 12.解: SO 2 ~ BaSO 4 1 mol 233 g x 11.65 g x = 0.05 mol
高温
△
高温
光照
△
△ △ 0.05 mol × 22.4 L = 1.12 L (1.12 L / 100 L )×100% = 1.12 % 作业二
1.D ;2.C ;3.B ;4.C ;5.B ;6.B ;7.C ;8.C ;9.D
10.排水法;易与氧气反应、不溶于水也不与水反应;向上排空气法;与水反应、比空气重;浓硫酸、氯化钙、五氧化二磷等;氢氧化钠溶液。
11.SO 2;H 2S ;Br 2;SO 2
12.⑴溶液褪色;溶液颜色恢复;SO 2 与H 2O 反应生成的H 2SO 3 不稳定,易分解为SO 2 与H 2O ;⑵溶液先变红后褪色;溶液变红;⑶否;否。
第四节
作业一
1.D ;2.C ;3.B ;4.D ;5.B ;6.D ;7.A 8.NH 3+H 2O =NH 3·H 2O ;混合物;NH 3·H 2O ;NH 3
9.⑴C a (O H )2 + 2NH 4Cl
CaCl 2 + 2NH 3↑+ 2H 2O ;⑵不能;氨气易溶于水;⑶ 用湿润的红色石蕊试纸靠近试管口;用蘸有浓盐酸的玻璃棒靠近试管口。
10.⑴NH 4HCO 3 +2NaOH =Na 2CO 3 + NH 3↑+ 2H 2O ;装置简单,无需加热,使用强健NaOH 对玻璃腐蚀作用大;⑵浓氨水具有挥发性,加入NaOH 固体后吸水,使氨水浓度更大,NaOH 固体溶解时又放热,使氨水溶液温度升高,而有大量氨气逸出;⑶在烧瓶中形成喷泉,并呈红色。NH 3 + H 2O NH 3·H 2O NH 4+ + OH -
11.21.0%;11.4 mol/L 作业二
1.D ;2.C ;3.A ;4.D ;5.A ;6.C ;7.C
8.(1)强氧化性(2)脱水性(3)H + 的氧化性(4)吸水性(5)酸性、强氧化性 9.⑴ Cu + 2H 2SO 4 CuSO 4 + SO 2↑+ 2H 2O ;蓝; ⑵ 品红溶液由红色变为无色;溶液由无色又变成红色;
⑶石蕊试液变红;吸收二氧化硫气体,防止污染空气;SO 2 + 2NaOH = Na 2SO 3 + H 2O 10.⑴ 2Na 2O 2 + SO 2 = 2Na 2SO 3 + O 2;
⑵ 取少量试样,加稀硫酸,产生的气体导入品红溶液,若品红溶液褪色,则白色固体中含有Na 2SO 3; ⑶ 不合理;稀硝酸能将BaSO 3氧化为BaSO 4;
如果反应后的固体中还残留Na 2O 2,它溶于水后能将亚硫酸根氧化成硫酸根。 11.0.1 mol ;0.2 mol/L 12.⑴ 2 mol/L ;⑵ 6.3 g 作业三
1.B ;2.D ;3.C ;4.B ;5.D ;6.D ;7.A ;8.C 9.CO 2和4 mol ·L -
1NaOH 溶液,NH 3和1 mol ·L
-1
盐酸
10.⑴①关闭玻璃管活塞A ,向U 型管长管一端加水至液面高于短管、静置一段时间后,若液面相对位置不变,则不漏气。 ②U 型管短管一端没有泡。 ③铜丝上有气泡。
⑵①无;NO 将硝酸溶液排入长管,使硝酸与铜脱离接触;②U 型管短管一端液面上升,干燥管的球型容器中有红棕色气体生成;Cu 与稀HNO 3反应生成NO 。
11.⑴ C + 2H 2SO 4 CO 2↑+ 2SO 2↑+ 2H 2O
⑵ SO 2、CO 2; H 2O ; ⑶ H 2O ; SO 2、CO 2; ⑷ SO 2、CO 2; H 2O 。 12.108
13.依题意可知,n (Cu)=0.03 mol ,铜与稀硝酸反应符合下列关系
△
△
△ 3Cu ~ 8HNO 3 3 8
0.03 0.04 铜过量,按硝酸进行计算
n (Cu)=0.04×3/8=0.015 mol 生成C u (N O 3)2 0.015 mol ,还原N O 3-
的物质的量为n (N O 3-
)=0.03 mol 。因为溶液中还含有H 2SO 4 =0.1 mol ·L -
1,即相当于溶液中还存在着0.02 mol 的硝酸,则又消耗Cu 的物质的量浓度为:n (Cu)=0.02×3/8
=0.0075 mol ,消耗 n (Cu)=0.0075 mol + 0.015 mol = 0.0225 mol c (Cu)= 0.0225 mol/0.1 L = 0.0225 mol/L
单元作业
1.B ;2.C ;3.B ;4.A ;5.D ;6.D ;7.C ;8.C ; 9.2Cu + O 2 2CuO ,CuO + H 2SO 4(稀)=CuSO 4 + H 2O ,
Cu + H 2SO 4(浓) CuSO 4 +SO 2↑+ 2H 2O ;第一种方法好。原因是①制得相同质量的产品,第一种方法消耗的硫酸少;②第二种方法生成的SO 2会造成大气污染;③第一种方法能节省能源。 10.⑴ ①②③④⑦;①⑤;⑵ ①③⑥;A ;⑶ ①②③④⑥⑦;B
11.⑴①氯水与NaOH 溶液反应,氯水过量,溶液显酸性;②氯水中的HClO 具有强氧化性,将有色色素氧化。 ⑵向褪色后的溶液中加入适量NaOH 溶液,若红色再现,则是上述原因①,若溶液颜色仍是无色,则是上述原因②。 12.NH 4+、Ba 2+;Al 3+、Fe 2+、SO 42-
、CO 32-
;Na +、NO 3
-
13.原混合气体中NO 和NO 2的体积分别为21 mL 和9 mL 。
