医疗机构传统中药制剂备案培训班报名回执表【模板】
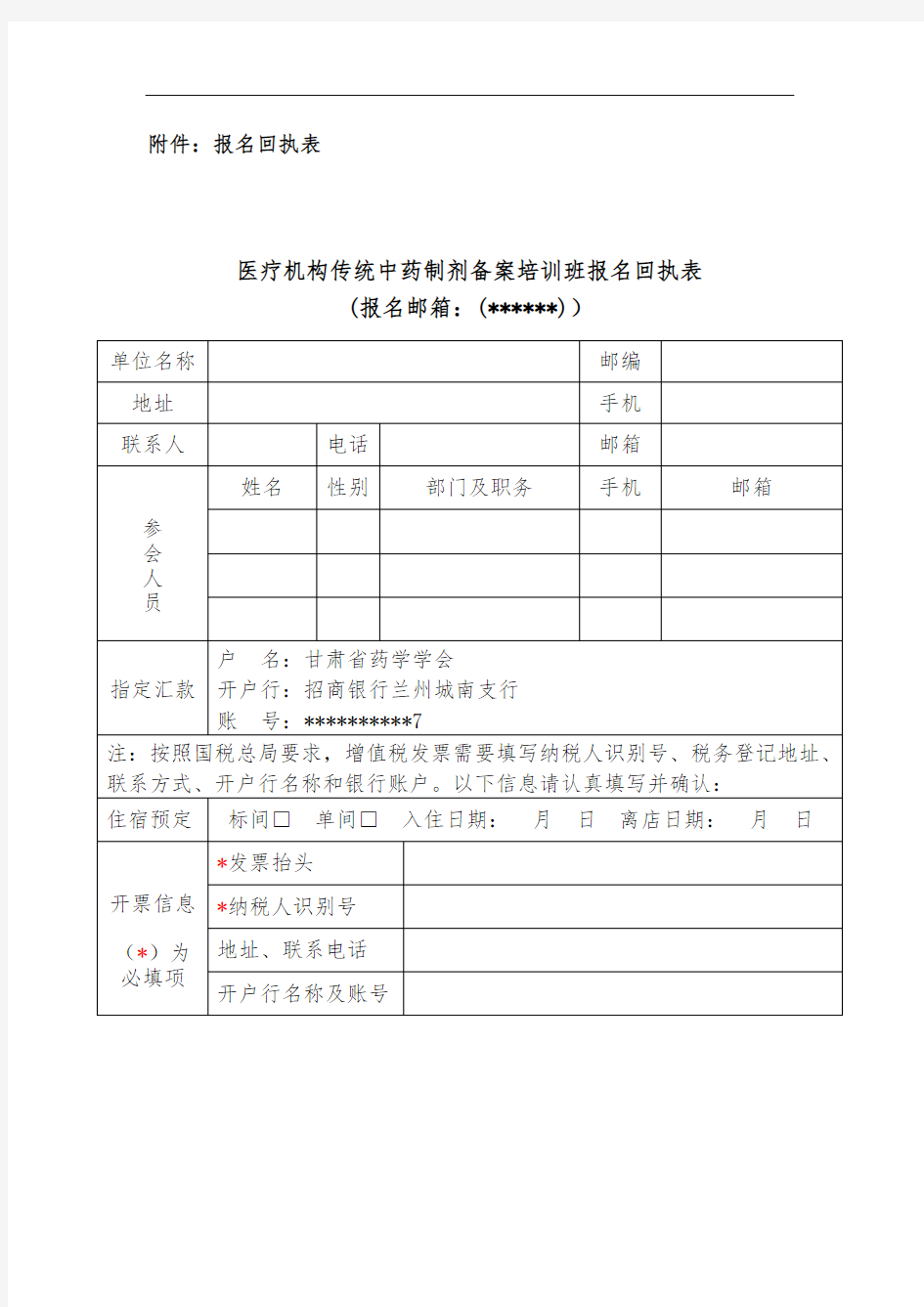
附件:报名回执表
医疗机构传统中药制剂备案培训班报名回执表
(报名邮箱:(******))
网站备案常见问题解答汇总
网站备案常见问题解答汇总 1、我修改了主体信息并想添加一个新的网站可以吗? 目前由于工信部系统的限制,需先对主体中的信息进行修改,待通过所在地通信管理的审核后,再对所要添加的新网站进行备案。 2、真实性核验需要提交哪些资料 (1). 网站备案信息真实性核验单一式两份,需网站负责人签字(请使用黑色签字笔,正楷填写),企业还需要盖公司公章。 江西地区用户,还需盖负责人手印;重庆地区用户请勿填写日期。 广东地区用户,请务必在核验单最下方空白处亲笔手抄承诺书内容并签名! 承诺书内容: “本人已履行网站备案信息当面核验手续,承认网站备案信息和核验记录真实有效,承诺本网站是个人网站,未含企业、单位等非个人网站的信息,承诺网站备案信息一旦发生变更,将及时进行更新,填报虚假备案信息、未履行备案变更手续、超出备案项目提供服务的,愿承担关闭网站并注销备案(列黑名单)等相应处理。” 广东个人用户:一个网站对应多个域名,请在网站信息中备注“N(N代表域名个数)个域名指向同一个网站”,不同前缀的域名,请分开填写核验单,一个账号(即一个备案号)下域名不得超过3个。
广东政府机关、事业单位:负责人需为法人代表。一个账号(即一个备案号)下,不得超过31个域名。 (2)信息安全保障协议书一式两份,需网站负责人签字(请使用黑色签字笔填写),企业还需要盖公司公章。 (3)主办者的证件。企业为公司营业执照复印件;个人为个人身份证正反两面复印件。(新增接入的用户,请在复印件背面留下负责人联系电话) (4)网站负责人证件。证件可以是:身份证、护照、台胞证、军官证的复印件,根据系统中实际填写的证件为准。(新增接入的用户,请在复印件背面留下负责人联系电话) (5)以下地区还需提供域名证书:辽宁、吉林、重庆、浙江(个人)、陕西、湖北、云南、山东、天津、湖南 3、如何打印域名证书? 你可以直接登录域名的管理平台,进入我的域名——> 点击要打印证书的域名——>点击右侧“证书”——> 连接好打印机就可以打印了。 当然,您也可以联系域名服务商(长江互联)提供域名证书。
医疗机构应用传统工艺配制中药制剂首次备案工作1.doc
医疗机构应用传统工艺配制中药制剂首次 备案工作1 广东省医疗机构应用传统工艺配制中药制剂首次备案工作指南(征求意见稿) 为贯彻落实《中华人民共和国中医药法》、《中华人民共和国药品管理法》和国家食品药品监督管理总局《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2018年第19号,下称《公告》),特制定本工作指南。 医疗机构应用传统工艺配制中药制剂(下称传统中药制剂)备案,是指医疗机构依照法定程序、条件和要求,将表明应用传统工艺配制的中药制剂的安全性、有效性、科学性、合理性、必要性和质量可控性的材料提交食品药品监督管理部门进行存档、公开、备查的过程。 1适用范围 本指南适用于国家总局《公告》中规定的传统中药制剂备案工作。 1.1由中药饮片经粉碎或仅经水或油提取制成的丸剂、散剂、丹剂、锭剂、煎膏剂(膏滋)、膏药、汤剂等传统剂型; 1.2由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂; 1.3由中药饮片用传统方法提取制成的酒剂、酊剂。
2备案主体 传统中药制剂备案人应当是本省省内医疗机构(下称申请人)。 3备案流程及要求 3.1获取备案信息平台登录帐号 申请人应向省食品药品监督管理部门提出获取备案信息平台登录帐号的申请。申请登录帐号的具体方式沿用省食品药品监督管理部门网上办事平台数字证书申请方式。 3.2产品备案信息填报、提交 申请人获得备案信息平台登录帐号后,通过省网上办事大厅(https://www.sodocs.net/doc/881167220.html,/sites/szck/gdsspypjdglj/index.html)找到传统中药制剂备案事项,点击进入平台,认真阅读并按照相关要求逐项填写申请人及申请传统中药制剂备案品种相关信息,打印系统自动生成的备案申请表,连同其他备案材料,逐页在文字处加盖申请人公章。 申请人将所有备案纸质材料清晰扫描成彩色电子版(PDF格式)上传至备案平台,确认后提交。 申请人已取得批准文号的传统中药制剂,在该批准文号有效期届满后,省食品药品监督管理部门不予再注册,符合备案要求的,进入备案平台后,可按规定进行备案(注册时已提供的材料,不需要重新提供);对此前已受理的此类制剂注册申请,申请人可选择申请撤回,改向省食品药品监督管理部门备案。
医疗机构应用传统工艺配制中药制剂变更备案资料要求
附件1 编号: 声明 我们保证: ①本次备案遵守《中华人民共和国中医药法》《中华人民共和国药品管理法》《中华人民共和国药品管理法实施条例》和《医疗机构制剂注册管理办法(试行)》等法律、法规和规章的规定; ②备案内容及所有备案资料均真实、来源合法、未侵犯他人的权益; ③一并提交的电子文件与打印文件内容完全一致。 如有不实之处,我们承担由此导致的一切法律后果。 备案事项 备案类型□首次□变更□年度报告 备案事由 制剂基本信息 制剂名称通用名称 剂型规格有效期汉语拼音 处方 (含辅料) 处方在本医疗机构是否具有5年以上(含5年)使用历史□是□否 处方中药味是否存在 以下情形含法定标准中标识有“剧毒”“大 毒”及现代毒理学证明有明确毒 性的药味 □是□否 备注含有十八反、十九畏配伍禁忌□是□否 配制工艺(含辅料) 功能主治用法用量 辅料信息名称生产企业执行标准 包装材料信息名称生产企业执行标准 备案机构信息 名称 《医疗机构执业许可证》登记号有效期限年月日至年月日 —11—
《医疗机构制剂许可证》□有 有无此 配制范围 □有编号 有效 期限 年月日至 年月日 □无 □无 制剂配制信息 是否委托配制□否制剂配制地址 □是 制剂配制单位 名称 《医疗机构制 剂许可证》 □是 编 号 有效 期限 年月日至 年月日《药品生产许 可证》 □是 制剂配制地址 联系人电话 制剂配制单位 法人代表 (签字) (公章) 年月日 备案变更信息(变更备案时填写) 序号历次备案号变更时间变更内容变更原因概述 年度报告信息(年度报告时填写) 报告年度年月日至年月日配制的总批次数: 内控制剂标准全检不合格的批次数: 使用数量: 变更情形汇总 变更内容变更时间对应的备案号 不良反应监测情况 不良事件/ 反应报告 □有报告例数: □无 风险控制主 要措施 □有主要措施: □无 备案资料有无无需备注□《医疗机构应用传统工艺配制中药制剂备案表》原件 □制剂名称及命名依据 □立题依据和目的、同品种及其他剂型中药制剂的市场供应情况 □证明性文件 □标签及说明书设计样稿 —12—
中药新药申报资料要求
附件1: 中药、天然药物注册分类及申报资料要求 本附件中的中药是指在我国传统医药理论指导下使用的药用物质及其制剂。 本附件中的天然药物是指在现代医药理论指导下使用的天然药用物质及其制剂。 一、注册分类及说明 (一)注册分类 1.未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂。 2.新发现的药材及其制剂。 3.新的中药材代用品。 4.药材新的药用部位及其制剂。 5.未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂。 6.未在国内上市销售的中药、天然药物复方制剂。 7.改变国内已上市销售中药、天然药物给药途径的制剂。 8.改变国内已上市销售中药、天然药物剂型的制剂。 9.仿制药。 (二)说明 注册分类1~6的品种为新药,注册分类7、8按新药申请程序申报。 1.“未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂”是指国家药品标准中未收载的从植物、动物、矿物等物质中提取得到的天然的单一成份及其制剂,其单一成份的含量应当占总提取物的90%以上。 2.“新发现的药材及其制剂”是指未被国家药品标准或省、自治区、直辖市地方药材规范(统称“法定标准”)收载的药材及其制剂。 3.“新的中药材代用品”是指替代国家药品标准中药成方制剂处方中的毒性药材或处于濒危状态药材的未被法定标准收载的药用物质。 4.“药材新的药用部位及其制剂”是指具有法定标准药材的原动、植物新的药用部位及其制剂。 5.“未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂”是指国家药品标准中未收载的从单一植物、动物、矿物等物质中提取的一类或数类成份组成的有效部位及其制剂,其有效部位含量应占提取物的50%以上。 6.“未在国内上市销售的中药、天然药物复方制剂”包括: 6.1中药复方制剂; 6.2天然药物复方制剂; 6.3中药、天然药物和化学药品组成的复方制剂。 中药复方制剂应在传统医药理论指导下组方。主要包括:来源于古代经典名方的中药复方制剂、主治为证候的中药复方制剂、主治为病证结合的中药复方制剂等。 天然药物复方制剂应在现代医药理论指导下组方,其适应症用现代医学术语表述。 中药、天然药物和化学药品组成的复方制剂包括中药和化学药品,天然药物和化学药品,以及中药、天然药物和化学药品三者组成的复方制剂。 7.“改变国内已上市销售中药、天然药物给药途径的制剂”是指不同给药途径或吸收部位之间相互改变的制剂。
企业网站备案需要提交的以及填写要求
企业网站备案需要提交的以及填写要求 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
企业网站备案需要提交的资料以及资料填写要求:(请仔细阅读) 一、需要QQ在线传给我的资料有: 1、公司营业执照副本彩色原件扫描件; 2、主体负责人身份证正反面彩色原件扫描件; 网站负责人身份证正反面彩色原件扫描件;(如果贵司已经有备案号,提供的主体负责人证件必须和之前域名备案信息中的主体负责人的证件一致,否则备案会因为证件不一致被退回;如果贵司之前没有备案过,主体负责人必须是法人); 3、备案申请必填信息表格(附件一); 4、PS好的网站负责人的现场拍照照片(背景图和效果图参考附件二附件三)。 如果网站负责人方便来我司拍照,可以直接来我司拍照,如果不方便过来则自行将上半身的照片PS在幕布背景图上,照片上的日期一定要和核验单上的日期同一天,可以暂时不加日期,PS的效果必须真实。 请将以上电子档的资料都准备齐全再整理成文件夹加上公司名一起通过QQ在线传给我,不要一个一个单独传。(第1、2、4项为jpg格式的图片;第3项为word文档) 二、需要快递的资料有:所有资料一式两份,均需加盖公章 三、友情提示:备案资料快递费用均由网站备案者自行承担!!
1、信息安全承诺书(附件四,打印出来盖章); 2、域名证书(请联系域名注册商提供有效的域名证书,核对域名所有者与网站主办单位身份的一致性,否则不予受理。(境内注册的域名一定要域名注册证书,境外就可以用whois查询打印,但前提是whois中的所有人信息要显示并且与备案主体是一致的) 3、备案申请必填信息(附件一); 4、网站备案信息真实性核验单(附件五); 网站备案信息真实性核验单打印出来,不能分页打印,只需填写主办单位名称(公司填写公司名称,)跟域名(必须打印出来,手写的不清晰无效),域名填写不要加www,在页面下方网站负责人签字处签字并盖章(签字一定要手写,并用黑色水性笔),盖章一定要清晰,切记不要盖章到核验人跟接入商那一个框。核验单下方签字的日期暂时不要填写,因为核验单上的日期必须和网站负责人来我司现场拍照的日期为同一天,打钩的地方不需要填。多个域名核验单必须分开填写,一个域名对应一份核验单。下图为核验单打印以及填写模板,请仔细核对核验单是否打印正确再快递。
ICPIP地址域名信息备案管理系统企业系统接口规范V3.1
工业和信息化部 ICP/IP地址/域名信息备案管理系统企业系统接口规范(3.1版) 2015年12月
目录 1、引言 (1) 1-1、目的 (1) 1-2、条件与限制 (1) 1-3、名词解释 (1) 1-4、规范性引用 (3) 2、接口功能 (5) 2-1、备案数据上报 (5) 2-2、备案数据下载 (6) 2-3、是否备案查询 (7) 2-4、备案密码校验 (7) 2-5、核验材料采集码获取接口 (8) 3、接口说明 (9) 3-1、接口概述 (9) 3-2、接口版本说明 (10) 3-3、接口说明 (10) 3-3-1、isp_upload方法 (10) 3-3-1-1、服务请求地址 (10) 3-3-1-2、方法原型 (10) 3-3-1-3、方法描述 (10) 3-3-1-4、参数描述 (12) 3-3-1-5、返回值 (12) 3-3-2、isp_download方法 (13) 3-3-2-1、服务请求地址 (13) 3-3-2-2、方法原型 (13) 3-3-2-3、方法描述 (13) 3-3-2-4、参数描述 (14) 3-3-2-5、返回值 (15) 3-3-3、isp_downloadack方法 (16) 3-3-3-1、服务请求地址 (16) 3-3-3-2、方法原型 (16) 3-3-3-3、方法描述 (16) 3-3-3-4、参数描述 (17) 3-3-3-5、返回值 (17) 3-3-4、isp_querypreviousupload方法 (17)
3-3-4-2、方法原型 (18) 3-3-4-3、方法描述 (18) 3-3-4-4、参数描述 (18) 3-3-4-5、返回值 (19) 3-3-5、isp_querybeianstatus方法 (20) 3-3-5-1、服务请求地址 (20) 3-3-5-2、方法原型 (20) 3-3-5-3、方法描述 (20) 3-3-5-4、参数描述 (20) 3-3-5-5、返回值 (21) 3-3-6、isp_verifybamm方法 (22) 3-3-6-1、服务请求地址 (22) 3-3-6-2、方法原型 (23) 3-3-6-3、方法描述 (23) 3-3-6-4、参数描述 (23) 3-3-6-5、返回值 (24) 3-3-7、isp_getcollectcode方法 (24) 3-3-7-1、服务请求地址 (24) 3-3-7-2、方法原型 (24) 3-3-7-3、方法描述 (24) 3-3-7-4、参数描述 (25) 3-3-7-5、返回值 (26) 3-4、接口返回状态代码表 (27) 3-5、数据处理结果代码表 (28) 4、数据格式 (35) 4-1、上报备案数据格式 (35) 4-1-1、ICP上报数据格式 (35) 4-1-1-1、新增备案 (36) 4-1-1-2、新增网站 (38) 4-1-1-3、新增接入 (39) 4-1-1-4、变更备案 (40) 4-1-1-5、注销备案 (43) 4-1-1-6、上报真实性核验材料电子件 (43) 4-1-1-7、核验材料接入商核实结果 (44) 4-1-1-8、核实结果 (44) 4-1-1-9、未备案网站处理结果 (44) 4-1-2、IP上报数据格式 (45)
备案信息填写规范
填写规范及要求 一、主办单位信息的填写 主办单位信息:网站名称(主办单位名称)和主办单位性质相符和,若您的站点属于个人站点,主办单位请填写您的姓名以及您的证件号码,若属于企业或者团体请填写单位名称以及单位证件或机构代码证号码! 常见企业填写规范: 填写项目填写要求 主办单位名称:与工商营业执照一致的公司名称 性质:企业 主办单位有效证件类型:工商营业执照号码
主办单位有效证件号码:工商营业执照号码 投资者或上级主管单位名称:公司名称或者法人姓名 主办单位所在地:XX省XX市 详细到街道门牌、大楼名称、楼层房间号主办单位通信地址: (学校地址应注明所在院、系或班级)! 证件住所:与工商营业执照注册地址一致 常见个人填写规范: 填写项目填写要求 主办单位名称:与身份证一致的个人姓名 性质:个人 主办单位有效证件类型:身份证 主办单位有效证件号码:二代身份证号码 投资者或上级主管单位名称:与主办单位名称一致 主办单位所在地:XX省XX市 详细到街道门牌、大楼名称、楼层房间号主办单位通信地址: (学校地址应注明所在院、系或班级)! 证件住所:与个人身份证地址一致 二、主体负责人基本信息/ 网站负责人基本信息的填写 以上号码均要求真实有效,相关部门会对网站信息进行不定期抽查拨测,如发现虚假无效信息或非本人信息将对其主体网站信息进行注销处理。
三、ICP网站信息的填写 网站名称:(1)需填写真实网站名称; (2)网站名称和主办单位性质相符和,个人网站不得为公司命名、非政府授权机构不得以政府或其他关键字命名; (3)网站名称中如包含“中国”、“中央”、“国家”等“国”字头命名网站需提供相关证件核实予以通过; (4)无新闻、出版、教育、卫生、药监、文化、广电等前置审批或专项审批的网站,不得以相关领域关键词命名。 网站首页网址:(1)每个主体下可添加多个网站,但每个网站有且只能有一个格式为https://www.sodocs.net/doc/881167220.html, 的网址;例: (2)每个网站首页网址下可添加多个域名,但有且只有一个网址 与域名相对例: 网站前置审 批项:如涉及到新闻、出版、教育、卫生、药监、文化、广电等前置审批或专项审批,需先到相关 部门进行前置审批,审核后下发文件提交至管局核实方可予以 审核备案。 网站服务内容:非经营性网站不得涉及到经营行为,如:电子商务、网上购物等。
中药、天然药物注册分类及申报资料要求
中药、天然药物注册分类及申报资料要求 一、注册分类及说明 (一)注册分类 1、未在国内上市销售的从中药、天然药物中提取的有效成份及其制剂。 2、未在国内上市销售的来源于植物、动物、矿物等药用物质制成的制剂。 3、中药材的代用品。 4、未在国内上市销售的中药材新的药用部位制成的制剂。 5、未在国内上市销售的从中药、天然药物中提取的有效部位制成的制剂。 6、未在国内上市销售的由中药、天然药物制成的复方制剂。 7、未在国内上市销售的由中药、天然药物制成的注射剂。 8、改变国内已上市销售药品给药途径的制剂。 9、改变国内已上市销售药品剂型的制剂。 10、改变国内已上市销售药品工艺的制剂。 11、已有国家标准的中成药和天然药物制剂。 (二)说明 1、“未在国内上市销售的中药、天然药物中提取的有效成份及其制剂”是指国家药品标准中未收载的从中药、天然药物中得到的未经过化学修饰的单一成份及其制剂。 2、“未在国内上市销售的来源于植物、动物、矿物等药用物质制成的制剂”是指未被国家药品标准或省、自治区、直辖市地方药材规范(以下简称“法定标准”)收载的中药材及天然药物制成的制剂。 3、“中药材的代用品”是指用来代替中药材某些功能的药用物质,包括: (1)已被法定标准收载的中药材; (2)未被法定标准收载的药用物质。 4、“未在国内上市销售的中药材新的药用部位制成的制剂”是指具有法定标准的中药材原动、植物新的药用部位制成的制剂。 5、“未在国内上市销售的中药、天然药物中提取的有效部位制成的制剂”是指从中药、天然药物中提取的一类或数类成份制成的制剂。 6、“未在国内上市销售的中药、天然药物制成的复方制剂”包括: (1)传统中药复方制剂; (2)现代中药复方制剂; (3)天然药物复方制剂。 7、“未在国内上市销售的中药、天然药物制成的注射剂”,其中包括水针、粉针、大输液之间的相互改变及其他剂型改成的注射剂。 8、“改变国内已上市销售药品给药途径的制剂”包括: (1)不同给药途径之间相互改变的制剂; (2)局部给药改为全身给药的制剂。 9、“改变国内已上市销售药品剂型的制剂”是指在给药途径不变的情况下改变剂型的制剂。 10、“改变国内已上市销售药品工艺的制剂”包括: (1)工艺有质的改变的制剂; (2)工艺无质的改变的制剂。 工艺有质的改变主要是指在生产过程中改变提取溶媒、纯化工艺或其他制备工艺条件等,使提取物的成份发生较大变化。 11、“已有国家标准的中成药或天然药物制剂”是指我国已批准上市销售的中药或天然药物制剂的注册申请。 二、申报资料项目 (一)综述资料 1、药品名称。 2、证明性文件。 3、立题目的与依据。 4、对主要研究结果的总结及评价。 5、药品说明书样稿、起草说明及最新参考文献。 6、包装、标签设计样稿。 (二)药学研究资料 7、药学研究资料综述。 8、药材来源及鉴定依据。 9、药材生态环境、生长特征、形态描述、栽培或培植(培育)技术、产地加工和炮制方法等。 10、药材性状、组织特征、理化鉴别等研究资料(方法、数据、图片和结论)及文献资料。
信息产业部ICPIP地址域名信息备案管理系统接入服务提供者用户使用手册
信息产业部ICP/IP地址/域名信息备案管理系统接入服务提供者用户使用手册 目录 1.1打开网页 (2) 1.2用户登录 (3) 1.3备案信息上报 (3) 1.3.1代为录入 (3) 1.3.2批量导入 (7) 1.3.4核实提交 (8) 1.4备案业务管理 (9) 1.4.1新增网站信息 (9) 1.4.2新增接入信息 (10) 1.4.3变更主体信息 (11) 1.4.4变更网站信息 (11) 1.4.5变更接入信息 (13) 1.5备案业务管理 (14) 1.5.1电子证书下载 (14) 1.5.2注销主体申请 (15) 1.5.3注销网站申请 (18) 1.6系统管理 (18) 1.6.1重置密码 (18) 1.7查询统计服务 (20) 1.7.1网站备案进度查询 (20) 1.7.2网站备案信息查询 (20) 1.7.3网站备案信息组合查询 (22) 1.7.4网站备案信息统计 (22) 1.8未备案网站管理 (23) 1.8.1未备案检测结果查询 (23) 1.8.2未备案检测结果统计 (24) 1.9黑名单查询 (25) 1.9.1备案信息黑名单查询 (25) 1.9.2非法接入黑名单查询 (26) 1.10公共查询 (26) 1.11修改密码 (27) 1.12修改个人信息 (28) 1.13意见反馈 (28) 1.14页面打印 (29) 1.15退出系统 (29)
1.1 打开网页 具体过程如下: 1)在IE浏览器中输入url地址(例:https://www.sodocs.net/doc/881167220.html,)进入备案系统主页面: 该页面为用户提供了以下功能和信息: ●用户登录入口 ●系统公告栏信息的查看 ●备案相关的法律法规查看 ●系统帮助包括备案流程、帮助文件 ●公共信息查询 ●意见反馈 ●政务公开
古代经典名方中药复方制剂的申报资料要求(征求意见稿)
古代经典名方中药复方制剂的申报资料要求(征求意见稿) 一、申报资料项目 (一)综述资料 1. 药品名称 2. 证明性文件 3. 沟通交流及研究者信息 4. 研究结果综述 5. 药品说明书样稿及起草说明 6. 包装、标签设计样稿 (二)药学研究资料 7. 药学研究综述 8. 药材 9. 饮片 10. 对应实物 11. 经典名方制剂 12. 药品标准 13. 稳定性 14. 检验报告 15. 其他资料 16. 参考文献
(三)非临床安全性研究资料 二、申报资料正文及撰写要求 (一)综述资料 1. 药品名称 古代经典名方中药复方制剂(以下简称经典名方制剂)的名称包括:中文名、汉语拼音名。制剂的药品名称原则上应当与已公布的《古代经典名方目录》中对应的方剂名称相同。 2. 证明性文件 证明性文件包括:申请人合法登记证明文件复印件;所用辅料及直接接触药品的包装材料(或容器)的注册证书复印件或登记号;国家相关法律法规要求提交的其他证明性文件复印件。 3. 沟通交流及研究者信息 3.1 沟通交流信息 申请前若与审评机构进行过沟通交流,应提供沟通意见建议以及相关情况说明。 3.2 研究者信息 提供主要研究人员(包括负责工艺、药品标准等研究的专家及项目负责人)的信息,包括姓名、工作单位、在相关研究中的作用等。若申请人独立研制,应说明。
4. 研究结果综述 对主要研究结果进行总结,综合评价所申报经典名方制剂的安全性、有效性及质量的可控性。 5. 药品说明书样稿及起草说明 5.1 说明书样稿 提供拟定的药品说明书样稿。申请人应按照确定的经典名方物质基准及经典名方说明书撰写要求,结合经典名方制剂的非临床安全性研究资料及其他相关研究完善说明书有关内容。 5.2 起草说明 提供药品说明书的起草说明。应根据品种的特点、经典名方制剂非临床安全性等相关研究整理完善说明书相关信息。 6. 包装、标签设计样稿 应提供按有关规定起草的包装、标签设计样稿。 (二)药学研究资料 7. 药学研究综述 总结制剂用药材的产地、采收期、产地初加工、生产方式及质量要求,简述药材资源评估情况。总结制剂用饮片规模化生产的炮制工艺及质量要求。说明基原、药用部位及炮制规格等信息与经典名方物质基准的一致性。
网站备案所需材料
网站备案所需材料 一、以企业或事业单位名义建立网站并备案 1.营业执照副本(企业)彩色扫描件或组织机构代码证(事业单位)彩色扫描件。 2.法人身份证原件的正、反两面彩色扫描件。 3.法人个人彩色照片(电子格式)。照片尺寸不低于800×600像素;免冠,双手自然下放,能够看到双手至头部的部位;照片的背景颜色为纯色(蓝色或白色),并且与着装形成明显的反差;不能配戴眼镜。 4.提交电子格式的《顶级国际域名证书》或《CN域名注册证书》。若在我处购买域名,则无需提供域名证书。 5.填写《网站备案信息真实性核验单》,并签字、盖章。只需以手写方式填写网站主办者名称、网站类型、网站域名、网站负责人签字(法人本人签字)、日期及盖章即可。盖章后,请扫描。 6.填写《信息安全管理承诺书》,并签字、盖章。只需以手写方式填写承诺单位名称、个人签字(法人本人签字)、签署日期及盖章即可。盖章后,请扫描。 二、以个人名义建立网站并备案 1.网站主办者身份证原件的正、反两面彩色扫描件。 2.网站主办者个人彩色照片(电子格式)。照片尺寸不低于800×600像素;免冠,双手自然下放,能够看到双手至头部的部位;照片的背景颜色为纯色(蓝色或白色),并且与着装形成明显的反差;不能配戴眼镜。 3.提交电子格式的《顶级国际域名证书》或《CN域名注册证书》。若在我处购买域名,则无需提供域名证书。 4.填写《网站备案信息真实性核验单》,并签字。只需以手写方式填写网站主办者名称、网站类型、网站域名、网站负责人签字(网站主办者本人签字)、日期及按手印即可。按手印后,请扫描。 5.填写《信息安全管理承诺书》,并签字。只需以手写方式填写承诺单位名称、个人签字(法人本人签字)、签署日期及按手印即可。按手印后,请扫描。
ICP备案变更流程
ICP备案变更流程 网站ICP备案信息变更,指对在本企业侧备案系统已经接入的备案信息进行变更。包括主体信息、网站信息或者接入信息的变更。此种操作需要用户的icp备案密码。 什么是ICP备案密码? 备案密码是客户在首次备案通过的时候,省通信管理局直接下发到备案时客户所留的邮箱和手机号码中,并不会发送给接入商。此密码由三个英文三个阿拉伯数字构成。请妥善保管,在操作变更备案和新增接入的时候会用到。 ICP备案密码丢失了或者找不到了怎么办,解决途径如下: 1、您可以通过系统找回。登陆https://www.sodocs.net/doc/881167220.html,,在右下角有“找回备案密码”按钮,选择主体所在省,在跳出的网页中,输入“备案/许可证号、证件类型、证件号码”,输入完成后点提交。如果信息填写正确,系统会向您当年注册的E-mail发送新备案密码。 2、如果您的备案信息是接入商代为备案的,您可以联系代为备案的接入商重置密码。 3、您也可以通过联系管局取回备案密码。 找回icp备案密码怎么无法登陆工信部备案系统
很多用户找通信管理局找回备案密码后,总反映说无法登陆系统。这里需要澄清的是,根据原来旧备案系统,通过用户名密码是可以直接登录的。但备案系统升级之后,改成了部、省、企业三级架构,用户要登录查看备案信息及备案状态,只能通过企业侧系统登录。 因此,新的备案系统架构中,密码包含两层:一是登录企业侧系统的密码,用户登录不同的企业侧系统可以自行设定,登录企业侧系统的密码找回、修改和重置由接入商系统和接入商负责;二是备案密码,即只有在接入商修改备案信息、注销备案等才使用该密码。该密码并不用来登陆企业侧备案系统。管局重置的是备案密码,并非用来登录的。 ICP备案信息变更时,是否需要提交核验单? 根据规定,ICP备案信息变更时,是否需要提供真实性核验单,请按以下要求处理: 1、当网站备案信息中的“主体信息”发生变化时,接入服务单位应按规程对更新信息进行当面核验。具体来说,若网站主办者为单位,当单位资质证明信息和网站负责人身份信息发生变化时,需当面核验;若网站主办者为个人,个人身份信息发生变化时,需当面核验。 2、当网站备案信息中的“联系方式”、“网站信息”发生变化时,不要求一定要当面核验,但也应及时核实更新,保证信息真实准确。 3、当网站备案信息中的“接入信息”发生变化时,接入服务单位应及时更新,保证信息真实准确。 ICP网站备案主体地址变更到另一个省份如何操作 主体地址变更到另一个省份,比如江苏的地址变成了上海的地址,备案该如何操作?是不是要注销备案号重新申请?原先二期系统可以直接修改备案信息的通信地址等有关信息即可。目前使用的三期系统,由于是部省企业三级架构,各省ISP提交的备案数据都要通过本省管局系统,因此,无法像二期那样直接改变通信地址。所以,目前的操作应该是:注销原先的备案,到新的所在省重新提交备
传统工艺配制中药制剂首次备案工作指南(征求意见稿)
广东省医疗机构应用传统工艺配制中药制剂首次备案工作指南(征求意见稿) 为贯彻落实《中华人民共和国中医药法》、《中华人民共和国药品管理法》和国家食品药品监督管理总局《关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告》(2018年第19号,下称《公告》),特制定本工作指南。 医疗机构应用传统工艺配制中药制剂(下称传统中药制剂)备案,是指医疗机构依照法定程序、条件和要求,将表明应用传统工艺配制的中药制剂的安全性、有效性、科学性、合理性、必要性和质量可控性的材料提交食品药品监督管理部门进行存档、公开、备查的过程。 1适用范围 本指南适用于国家总局《公告》中规定的传统中药制剂备案工作。 1.1由中药饮片经粉碎或仅经水或油提取制成的丸剂、散剂、丹剂、锭剂、煎膏剂(膏滋)、膏药、汤剂等传统剂型; 1.2由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂; 1.3由中药饮片用传统方法提取制成的酒剂、酊剂。 2备案主体
传统中药制剂备案人应当是本省省内医疗机构(下称申请人)。 3备案流程及要求 3.1获取备案信息平台登录帐号 申请人应向省食品药品监督管理部门提出获取备案信息平台登录帐号的申请。申请登录帐号的具体方式沿用省食品药品监督管理部门网上办事平台数字证书申请方式。 3.2产品备案信息填报、提交 申请人获得备案信息平台登录帐号后,通过省网上办事大厅(https://www.sodocs.net/doc/881167220.html,/sites/szck/gdsspypjdglj/index.html)找到传统中药制剂备案事项,点击进入平台,认真阅读并按照相关要求逐项填写申请人及申请传统中药制剂备案品种相关信息,打印系统自动生成的备案申请表,连同其他备案材料,逐页在文字处加盖申请人公章。 申请人将所有备案纸质材料清晰扫描成彩色电子版(PDF格式)上传至备案平台,确认后提交。 申请人已取得批准文号的传统中药制剂,在该批准文号有效期届满后,省食品药品监督管理部门不予再注册,符合备案要求的,进入备案平台后,可按规定进行备案(注册时已提供的材料,不需要重新提供);对此前已受理的此类制剂注册申请,申请人可选择申请撤回,改向省食品药品监督管理部门备案。
中药制剂申报资料8年前模板-8号资料
药材来源及鉴定依据 1丹参Danshen RADIX ET RHIZOMA SALVIAE MILTIORRHIZAE 基源:本品为唇形科植物丹参Ralvia miltiorrhiza Bge的干燥根及根茎。 主产地:主产四川、山西、河北、江苏、安徽。 鉴定依据:《中华人民共和国药典》2005版一部第52页丹参项下的有关规定。 2没药Moyao MYRRHA 基源:本品为橄榄科植物没药树Commiphora myrrha Engl.或爱伦堡没药树Balsamodendron ehrennbergianum Berg.的干燥胶树脂。前者习称“天然没药”,后者习称“胶质没药”。 主产地:广西、广东、海南。 鉴定依据:《北京市中药饮片标准》第329页没药项下的有关规定。 3鸡血藤Jixueteng CAULIS SPATHOLOBI 基源:本品为豆科植物密花豆Spatholobus suberectus Dunn的干燥藤茎。 主产地:广西。 鉴定依据:《中华人民共和国药典》2005版一部第134页鸡血藤项下的有关规定。 4血竭Xuejie SANGUIS DRACONIS 基源:本品为棕榈科植物麒麟竭Daemonorops draco Bl.果实渗出的树脂经加工制成。 主产地:广东、台湾。 鉴定依据:《中华人民共和国药典》2005版一部第96页血竭项下的有关规定。 5延胡索Yanhusuo RHIZOMA CORYDALIS
基源:本品为罂粟科植物延胡索Corydalis yanhusuo W.T.的干燥块茎。 主产地:浙江磐安、东阳。 鉴定依据:《中华人民共和国药典》2005版一部第94页延胡索项下的有关规定。 6当归Danggui RADIX ANGELICAE SINENSIS 基源:本品为伞形科植物当归Angelica sinensis(Oliv。)Diels的干燥根及根茎。 主产地:主产甘肃、云南、四川;多栽培。 鉴定依据:《中华人民共和国药典》2005版一部第89页当归项下的有关规定。 7郁金Yujin RADIX CURCUMAE 基源:本品为姜科植物温郁金Curcuma wenyujin Y.H.Chenet C.Ling姜黄Curcuma longa L.广西莪术Curcuma kwangsiensis S.G.Lee et C.F.Liang 或蓬莪术Curcuma phaeocaulis Val.的干燥块根。 主产地:浙江、四川、广东、广西、云南、福建、台湾、江西。 鉴定依据:《中华人民共和国药典》2005版一部第144页郁金项下的有关规定。 8制何首乌Zhiheshouwu RADIX POLYGONI MULTIFLORI PRAEPARATA CUM SUCCO GLUCINES SOTAE 基源:本品为何首乌的炮制加工品。 主产地:河南、广东、贵州、江苏、湖北、四川。 鉴定依据:《中华人民共和国药典》2005版一部第123页制何首乌项下的有关规定。 9桃仁Taoren RADIX ET RHIZOMA SALVIAE 基源:本品为唇形科植物丹参Ralvia miltiorrhiza Bge的干燥根及根茎。 主产地:山东。
接入服务商手册—备案管理系统复习课程
工业和信息化部ICP/IP地址/域名信息备案管理系统(部级系统、各省管局系统)——接入服务商使用手册 2010-06
目录 一、引言 (3) 二、使用过程 (3) 2.1角色和权限 (3) 2.2企业侧系统与省局系统的对接 (3) 2.2.1 企业提交基本信息 (3) 2.2.2 通讯参数信息的产生 (4) 2.3企业侧系统与省局系统的信息交互 (4) 2.3.1 ICP备案的信息交互 (4) 2.3.2 IP地址报备的信息交互 (4) 2.3.3 域名注册信息报备的信息交互 (5) 2.4接口上传和下载数据内容 (5) 2.4.1 上报备案数据 (5) 2.4.2 下载备案数据 (6)
一、引言 编写本用户手册的目的是:指导使用“ICP/IP地址/域名信息备案管理系统”的有关人员能更有效的操作和管理该系统。 该用户使用手册的预期读者为:接入服务商 二、使用过程 2.1 角色和权限 接入服务商即互联网业务提供商(ISP:Internet Service Provider)是为网站提供接入互联网服务的单位,包括因特网接入服务提供者(即ISP)和因特网数据中心(即IDC)。在网站备案管理系统中具有ICP报备和IP地址报备权限; 域名注册服务管理机构和域名注册服务机构具有域名注册信息的报备权限。 2.2 企业侧系统与省局系统的对接 2.2.1 企业提交基本信息 省局系统用户管理中可以按照接入商的角色进行权限分配,填写接入服务商相关内容,创建账号,产生系统对接所需的通讯参数信息: ●向管理部门报备企业系统接入的IP地址 准备接入的企业上报企业接口服务器的IP地址,只有这个IP 地址下的服务器方可与省系统对接。 ●向管理部门报备本企业基本信息 单位名称、单位性质、经营许可证号等基础信息。(参考二期系统) 企业侧系统对用户开放的注册、报备页面URL。
院内制剂备案后即可配制
院内制剂备案后即可配 制 Revised as of 23 November 2020
院内制剂备案后即可配制 三)中药制剂 1、验方:生产符合国家规定条件的来源于古代经典名方的中药复方制剂,在申请药品批准文号时,可以仅提供非临床安全性研究资料; 2、鼓励医疗机构根据本医疗机构临床用药需要配制和使用中药制剂,支持应用传统工艺配制中药制剂,支持以中药制剂为基础研制中药新药; 3、仅应用传统工艺配制的中药制剂品种,向医疗机构所在地省、自治区、直辖市人民政府药品监督管理部门备案后即可配制; 4、将符合条件的医疗机构中药制剂纳入基本医疗保险基金支付范围。 《中华人民共和国中医药法》各省实施细则 中医药法建言】备案制并非院内制剂的通行证 《中医药法(草案)》第22条指出:“国家鼓励医疗机构根据本医疗机构临床用药需要配制和使用中药制剂,支持应用传统工艺配制中药制剂,支持以中药制剂为基础研制中药新药……医疗机构配制的中药制剂品种,应当依法取得制剂批准文号。但是,仅应用传统工艺配制的中药制剂品种,向医疗机构所在地省、自治区、直辖市人民政府药品监督管理部门备案即可配制,不需要取得制剂批准文号。”中药制剂由原来的“注册制”改为“备案制”,放宽了对中药制剂的管理,业内专家怎么看南方医科大学中西医结合医院药剂科主任张鑫
《中医药法(草案)》向社会公开征求意见,这是我国中医药领域的一大进步。《中医药法(草案)》第22条将中药制剂由原来的“注册制”改为“备案制”,笔者认为,这对于我国中医药事业的发展是利大于弊,备案制的实施必将对我国中药事业的发展起到积极的推动作用。 中药制剂备案制的优势主要表现在四方面。 1.快捷、方便:备案制会使医疗机构配制的中药制剂取得制剂批准文号的时间缩短,在手续上表现为更快捷、更方便。 2.成本风险降低:申报自制制剂需作生产工艺、毒理、药效、质量标准检验和取得临床有效数据,而完成一个品种的所有实验项目需要几万元至几十万元的费用。在一定程度上,备案制会降低医疗机构配制的中药制剂前期研发的投入成本与风险。 3.研发积极性提高:备案制将使广大医务工作者研发中药制剂的积极性大大提高。医疗机构中药制剂多为临床验方,《中医药法(草案)》第二十二条若能落实,将促进广大医务工作者尽可能收集日常工作中的经方、验方,并将其用于医疗机构中药制剂的开发。 4.应用更加广泛:备案制会使安全有效的医疗机构配制的中药制剂更好地为广大患者服务,有利于推动我国中医药事业的发展等。 但必须明确的是,并不是医疗机构配制的所有中药制剂均实行备案制,《中医药法(草案)》指出:“仅利用传统工艺配制的中药制剂品种”实行备案制。因此,笔者认为国务院和CFDA(国家食品药品监督管理总局)应及早颁布《中华人民共和国中
中药制剂申报资料
生产工艺的研究资料及文献资料,辅料来源及质量标准 12.1 生产工艺:处方、制法、工艺流程 12.1.1 处方 丹参112.5g 没药(炒) 25.5g 鸡血藤112.5g 血竭25.5g 延胡索(醋制) 45g 当归45g 郁金45g 制何首乌75g 桃仁(炒) 30g 黄精(蒸) 75g 红花30g 粉葛112.5g 乳香(炒) 25.5g 冰片 4.5g 甜菊素10g 糊精适量 制成颗粒1000g 12.1.2 制法 以上十四味,冰片研细;粉葛、乳香、没药、血竭、郁金、延胡索粉碎成细粉,过100目筛;其余丹参等七味加水煎煮二次,第一次加10倍量水煎煮 3 小时,第二次加8 倍量水煎煮 2 小时,合并煎液,滤过,浓缩成相对密度为 1.20 (60℃)的清膏,与上述粉葛等细粉混合,加入适量甜菊素、糊精制成颗粒,干燥,整粒,将冰片用适量乙醇溶解,喷入至上述颗粒,混匀,低温干燥,制成 1000g,即得。 12.1.3 工艺流程图
丹参、鸡血藤、红花、桃仁(炒)、 粉葛、乳香、没药、血竭、郁金、延胡索当归、黄精(蒸)、制何首乌 加水煎煮两次,第一次加10 倍量水,煎煮 3 小时, 第二次加8 倍量水,煎煮 2 小时,合并煎液,滤过 滤液 浓缩至相对密度为 1.20(60℃)的清膏粉碎,过100 目筛稠膏 加入甜菊糖和糊精,制成 颗粒、干燥、整粒 颗粒 将冰片用适量乙醇溶解, 喷入,低温干燥 颗粒 包装 成品 12.2 制剂工艺研究的试验资料 12.2.1 剂型选择 “*** 颗粒”是由《部颁中药成方制剂》第十册中收载的品种“*** 片”改剂 型而来的,本品具有活血化瘀,行气止痛的功效。用于以胸部刺痛、固定不移、 入夜更甚、心悸不宁,舌质紫暗,脉沉弦为主症的冠心病,心绞痛,冠状动脉供 血不足。*** 片临床应用疗效较好,但其为糖衣片,部分患者不适合选择含糖药 物,且片剂不易吞服,患者在剂型选择的时候余地较小,在一定程度上限制了患
域名添加ICP备案号操作流程
域名添加ICP备案号操作流程 一、分公司预注册系统提交工单及要求 1、原备案用户名:密码: 2、原备案主办单位名称: 3、原备案的网站域名: 4、原备案取得的备案号: 5、新添加的域名: 6、新添加域名的网站名称(注明:写单位名称): 7、新添加域名指向的IP(无需分公司填写): 8、网站负责人姓名: 9、网站负责人有效证件类型:身份证 10、网站负责人有效证件号码: 11、网站负责人办公电话: 12、网站负责人中国移动手机号码: 13、网站负责人电子邮箱: 14、请注明新添加的域名有无涉及前置审批(从事新闻、出版、教育、医疗保健、药品和医疗器械等互联网信息服务) 二、需要客户出具的具体资料(相关表格模板见附件) 广东省内客户资料无变化(即仍为以下7点电子版) 1、企业:清晰有效的企业营业执照原件扫描上传至扫描系统。(副本、年检) 事业单位:清晰有效的组织机构代码证原件扫描上传至扫描系统。 2、主办单位负责人(即网站负责人)身份证原件扫描件(正反两面,扫描至同一张纸)以及《法人授权书》签字加盖红色公章,原件扫描件上传至扫描系统。 备注:如果负责人姓名与法人代表姓名相同,则只需要提供法人代表人的身份证原件扫描件(正反两面,扫描至同一张纸)即可,无需提供《法人授权书》。 3、《信息安全管理协议书》甲方处签名加盖红色公章,原件扫描件上传至扫描系统。
4、《网站备案信息真实性核验单》网站负责人签字处签字,单位盖章处加盖红色公章。原件扫描件上传至扫描系统。 备注:核验人处为接入商填写信息,无需客户填写盖章。 5、域名证书原件扫描件上传至扫描系统。(多个域名至提供一份证书即可) 6、主办单位负责人(即网站负责人)彩色半身有肩纯底色照片一张。像素为:800*600。扫描至扫描系统。 7、《域名授权书》:当域名所有人与备案单位名称不一致时,需要出具该授权书。要求授权人和被授权人签字盖章,原件扫描至扫描系统。 广东省外客户(以下需要邮寄的资料需等总部审核通过之后方可) 1、企业:清晰有效的企业营业执照原件扫描上传至扫描系统。(副本、年检)事业单位:清晰有效的组织机构代码证原件扫描上传至扫描系统。 复印件加盖红色公章2份邮寄至总部。 2、主办单位负责人(即网站负责人)身份证原件扫描件(正反两面,扫描至同一张纸)以及《法人授权书》签字加盖红色公章,原件扫描件上传至扫描系统。 备注:如果负责人姓名与法人代表姓名相同,则只需要提供法人代表人的身份证原件扫描件(正反两面,扫描至同一张纸)即可,无需提供《法人授权书》。身份证复印件及《法人授权书》原件加盖红色公章各2份邮寄至总部。 3、《信息安全管理协议书》甲方处签名加盖红色公章,原件扫描件上传至扫描系统。 签订2份原件加盖红色公章,邮寄至总部。 4、《网站备案信息真实性核验单》网站负责人签字处签字,单位盖章处加盖红色公章。原件扫描件上传至扫描系统。 备注:核验人处为接入商填写信息,无需客户填写盖章。 签订 2份原件加盖红色公章,邮寄至总部。 5、域名证书原件扫描件上传至扫描系统。(多个域名至提供一份证书即可) 6、主办单位负责人(即网站负责人)彩色半身有肩纯底色照片一张。像素为:800*600。扫描至扫描系统。 7、《域名授权书》:当域名所有人与备案单位名称不一致时,需要出具该授权书。要求授权人和被授权人签字盖章,原件扫描至扫描系统。
相关文档
- 传统中药制剂备案管理课件
- 医疗机构应用传统工艺配制中药制剂实施备案管理政策的解读-百度文库
- 关于加强医疗机构中药制剂管理的意见
- 医疗机构应用传统工艺配制中药制剂实施备案管理之见解
- (医学课件)中药制剂备案管理
- 院内制剂备案后即可配制
- 中药制剂备案管理ppt课件
- 中药制剂备案管理
- 医疗机构应用传统工艺配制中药制剂备案表
- 中药制剂实施备案管理的XX
- 重庆医疗机构应用传统工艺配制中药制剂备案管理实施细则
- 中药制剂备案管理
- 传统工艺配制中药制剂首次备案工作指南(征求意见稿)
- 总局关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告(2018年第19号)
- 中药制剂备案管理
- 医疗机构应用传统工艺配制中药制剂备案表
- 江苏医疗机构应用传统工艺配制中药制剂备案管理实施细则
- 中药制剂备案管理
- 院内制剂备案后即可配制
- 传统中药制剂备案管理培训课件
