高中参考资料学科竞赛汇总表
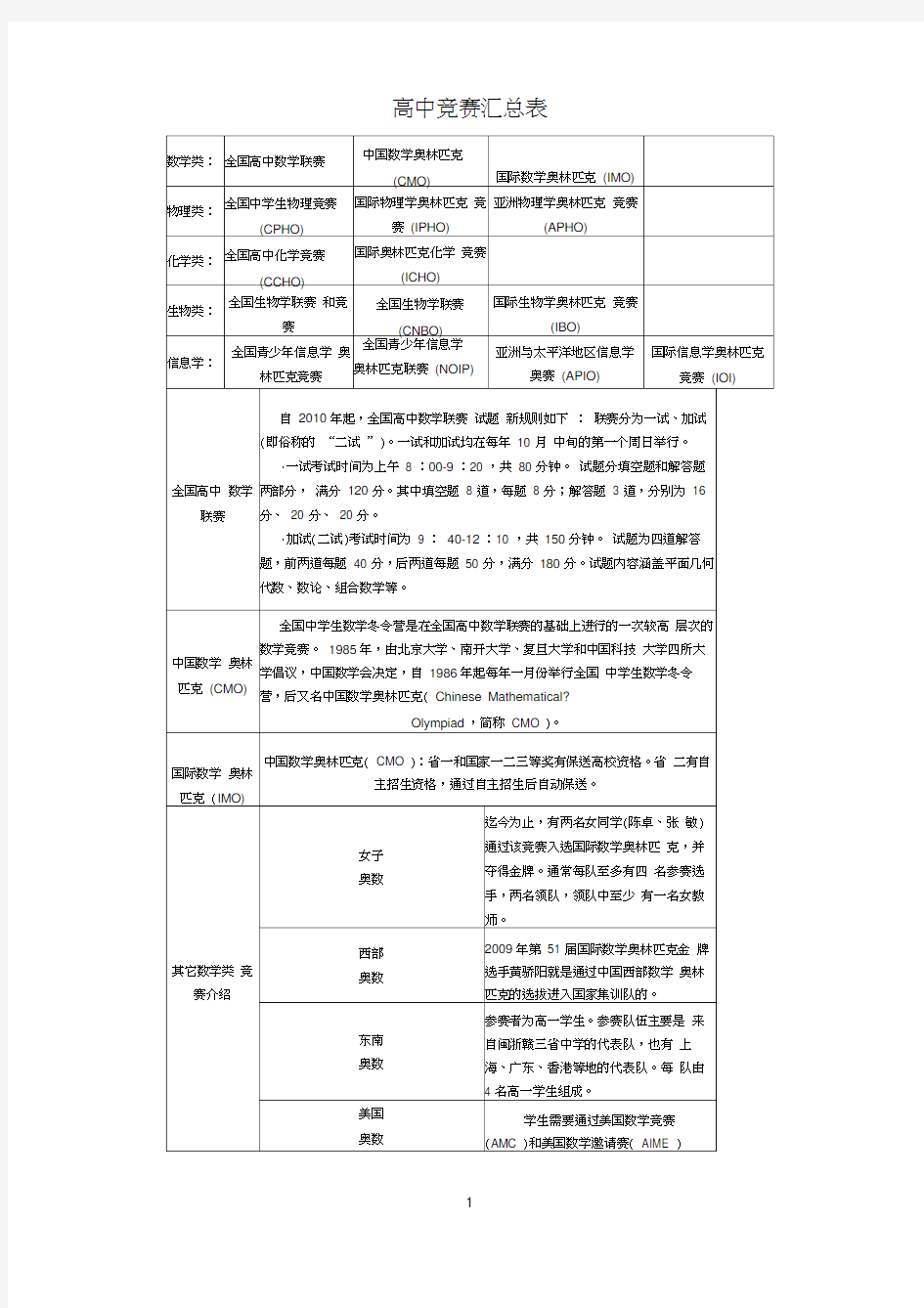

高中竞赛汇总表
高中化学竞赛辅导练习参考答案与解析
智浪教育-普惠英才文库 高中化学竞赛辅导练习参考答案与解析 第一章元素与化合物 第一节卤素 一.1.IO3-十5I-+6CH3COOH===3I2+6CH3COO-+3H2O 2.KI在潮湿空气里,在阳光的作用下会被空气氧化而产生紫黑色固体(或紫色蒸气),而KIO3不被空气氧化。4I-+O2+2H2O===2I2+4OH-二.l.(1)主要反应:I2+2KClO3==2KIO3+C12↑ (2)可能的副反应:C12+H2O(冷)==HClO+HCl C12+H2O==2HCl+1/2O2 3C12+3H2O(热)==HClO3+5HCl I2+5Cl2+6H2O==2HIO3+10HCl 一步:I2+5H2O2? ?催化剂2HIO3+4H2O ?→ 二步:2HIO3+K2CO3==2KIO3+CO2↑+H2O 2.使氧化生成的I2再还原为碘化物 I2+2S2O32-==S4O62-+2I- 三.3I2+6OH-===IO3-+5I-+3H2O S2O32-+4I2+10OH-===2SO42-十8I-+5H2O S2O32-+2H+===SO2↑十S↓+H2O 4I-+O2+4H+===2I2+2H2O 四.加入过量KI生成I3-离子以减少I2挥发 1.在强酸性溶液中S2O32-遇酸分解,且I-易被空气氧化:(反应略);在碱性溶液中: S2O32-+4I2+10OH-===SO42-+8I-+5H2O 3I2+6OH-===IO3-+5I-+3H2O 上述到反应的发生,使定量反应难以准确. 2.前者,I2与S2O32-的反应速度大于I2与OH-的反应速度;后者,S2O32-与I2的反应速度大于S2O32-与H+的反应速度。 五.I2(反应略) 七.A CaF2 B H2SO4 C HF D NaF E NaHF2 九.紫2I-+CI2===I2+2CI- 棕紫2Br-+Cl2===Br2+2Cl- 棕红色I2+5Cl2+6H2O===2IO3-+5Cl-+12H+ 十.A AgNO3 B AgCl C [Ag(NH3)2]Cl D AgBr E Na3[Ag(S2O3)2] F Agl G Na[Ag(CN)2] H Ag2S (反应略) 十三.1.该固体一定含钠和碘,使煤气灯火焰显黄色表明钠的存在;不溶于NH3,而溶于强络合剂CN-或S2O32-的黄色银盐一定是碘化银。
高中化学竞赛全套资料
初赛基本要求 1.有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液 管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2.气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分 压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3.溶液溶液浓度。溶解度。浓度与溶解度的单位与换算。溶液配制(仪器的选择)。重 结晶的方法及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。 胶体的分类。胶体的基本结构。 4.容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴定曲 线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。 以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应。分析结果的计算。分析结果的准确度和精密度。 5. 原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子 和负离子)核外电子排布。电离能、电子亲合能、电负性。 6.元素周期律与元素周期系周期。1—18族。主族与副族。过渡元素。主、副族同族元 素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。原子半径和离子半径。s、p、d、ds区元素的基本化学性质和原子的电子构型。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高氧化态与族序数的关系。对角线规则。金属与非金属在周期表中的位置。半金属(类金属)。主、副族的重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。铂系元素的概念。 7.分子结构路易斯结构式。价层电子对互斥模型。杂化轨道理论对简单分子(包括离子) 几何构型的解释。共价键。键长、键角、键能。σ键和π 键。离域π键。共轭(离域)体系的一般性质。等电子体的一般概念。键的极性和分子的极性。相似相溶规律。对称性基础(限旋转和旋转轴、反映和镜面、反演和对称中心)。 8.配合物路易斯酸碱。配位键。重要而常见的配合物的中心离子(原子)和重要而常见的配体(水、羟离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和烃等)。螯合物及螯合效应。重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的关系(定性说明)。配合物几何构型和异构现象基本概念和基本事实。配合物的杂化轨道理论。用杂化轨道理论说明配合物的磁性和稳定性。用八面体配合物的晶体场理论说明Ti(H2O)63+的颜色。软硬酸碱的基本概念和重要的软酸软碱和硬酸硬碱。 9.分子间作用力范德华力、氢键以及其他分子间作用力的能量及与物质性质的关系。 10.晶体结构分子晶体、原子晶体、离子晶体和金属晶体。晶胞(定义、晶胞参数和原子 坐标及以晶胞为基础的计算)。点阵(晶格)能。配位数。晶体的堆积与填隙模型。常见的晶体结构类型:NaCl、CsCl、闪锌矿(ZnS)、萤石(CaF2)、金刚石、石墨、硒、冰、干冰、金红石、二氧化硅、钙钛矿、钾、镁、铜等。 11.化学平衡平衡常数与转化率。弱酸、弱碱的电离常数。溶度积。利用平衡常数的计算。 熵(混乱度)的初步概念及与自发反应方向的关系。 12.离子方程式的正确书写。
中学优质课评选实施方案
**中学高效课堂教学大赛实施方案 一、指导思想: 在**县教育工作会胜利召开之际,以创建教育强县为契机,结合我县“高举质量大旗,打造有效课堂教学”的办学精神,大力推进基础教育课程改革,有效增进课堂教学管理,改变教学方式,提高课堂效率;为教师创造公平竞争的机会,搭建展示课堂教学本领的舞台,提升课堂教学执教能力,促使教师个人专业化成长,实现“课堂教学效益最大化”,特举办本次优质课评选活动。 二、评比原则 1、科学性、导向性原则。有效教学管理,体现新课程理念,采用新的教学方法和教学手段,提高课堂教学效益。 2、公正性、公平性原则。在评选工作中要采取措施保证评选出的教师具有示范性、榜样性。 三、组织领导 为保证评选活动的顺利开展,成立麻镇中学优质课评比领导小组。 组长:*** 副组长:*** **** 主要成员:***、***、***、*** 四、时间:*月*日至**日。 五、参加对象 全校所有科任教师。
六、评比形式及分数 学生学习情况占60分,教师导学情况占40分。 七、评比办法 1、参评教师通过教务处每周统一安排在指定班级上课。上课前一天,在行政会议室说课(带说课稿2份,教案复印件2份)。全体评委和本组成员参与。 2、评比成绩由各评委给分中去掉最高分和最低分,取剩余人平均分。 3、课堂教学评价以新课改要求为准绳,结合《****高效课堂教学评价表》,公正、公平量化教师课堂教学。 4、评比活动在教务处领导下进行,各教研组密切配合。 八、表彰奖励: 1、依据综合评比成绩,按得分高低评出一、二、三等奖,分别占10%,20%,30%。 2、另外从获奖选手中评选4名选手参加**县高效课堂教学大赛决赛(其中高中*名,初中*名)。条件为: (1)师德高尚,为人师表,无任何违纪违法行为。 (2)年龄在35周岁以下(含35周岁),教龄在3年以上(不含3年)。 (3)必须要有县级及县级以上发表或获奖论文。 (4)必须参与校级及校级以上的课题研究。
全国高中化学竞赛经典试题
全国高中化学竞赛试题集萃(五) 二、本题包括5小题,共29分。 26. (3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO 4溶液。 ⑴经过一段时间后,观察到的现象是(指金属圈) 。 A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变 C.铁圈向下倾斜 D.银圈向下倾斜 ⑵产生上述现象的原因是 。 27. (4分)以铜为阳极,石墨为阴极,用含3~5gNaOH 的15%NaCl 的混合溶液做电解液,外加电压为 1.5V 电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为 ,阴极反应式为 ;电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征: 和 。 28. (10分)下图中E 是一种固体的非金属单质,A 、B 、D 、F 、G 、H 中都含有E 元素,A 、C 、F 、H 、G 都含有相同的阳离子,G 加入含碘的淀粉蓝色溶液,蓝色褪去。 ⑴试写出A ~H 的分子式; A ; B ; C ; D ; E ; F ; G ; H 。 ⑵写出G 与单质碘反应的离子方程式。 29. (5分)某溶液中可能含有下列物质中的两种:HCl 、NaOH 、NaH 2PO 4、Na 3 PO 4、H 3 PO 4和Na 2HPO 4。 ⑴这六种物质两两间可能形成 种互相不发生反应的组合。 ⑵取某种组合溶液,滴入甲基红指示剂后为黄色(pH=6.2),再滴入酚酞指示剂后仍是黄色(酚酞无色,pH ≤8.0),则此组合是 和 的组合液。 ⑶取另一组合溶液xmL ,以甲基橙作指示剂,用c mol/LNaOH 溶液滴定至红橙色(此时pH 约为9.6左右),又消耗V 1mL(V>V 1),试确定此组合溶液是 和 物质组成的。 30. (7分)我国东方Ⅱ号宇宙火箭的燃料是N 2H 2(CH 3)2,助燃剂为N 2O 4,两者发生完全燃烧时产生了巨大推力,让火箭携带卫星上天。 ⑴N 2H 2(CH 3)2中N 的氧化数为 ,N 2O 4中N 的氧化数为 。 ⑵完全燃烧反应的化学方程式为 。 ⑶试写出N 2O 4中N 、N 连接的一种Lewis 结构式并标出形式电荷 。 ⑷N 2H 4与N 2O 4比较, 的N -N 键长较长,其理由是 。 H G E A F B C D O 2 NH 3·H 2O HCl
初中基础学科竞赛方案
2017-2018学年度学科竞赛活动方案 一、指导思想: 为了进一步丰富我校学生的校园文化生活,更加扎实各门学科的基础知识,巩固各门学科教学成果,激发学生学习各门学科的兴趣,以“发展学生思维,创建展示自我的舞台”为宗旨,拟定于从10月份开始,每月举行一次七、八、九年级主要学科知识竞赛活动。竞赛活动在“以学生发展为本”理念的指导下,以各年级各班级为单位,在教务处组织下逐项开展。 二、活动目的: 1、着重考察学生各学科知识的掌握情况,各学科的基础知识和基本技能。 2、着重考察学生的生活实际和密切相关及对知识的领悟能力,巩固和运用能力。 3、着重考察学生在课外实践过程中所熟悉掌握的知识情况。 三、竞赛活动时间、地点: 1、从10月份开始,每月考一次。 2、每场考试60分钟,满分100分。 3、考试时间:大课间+大课间后的一节课。 4、考试地点:四楼会议室。 四、竞赛学科及对象: 七年级的语文、数学、英语; 八年级的语文、数学、英语、物理; 九年级的语文、数学、英语、物理、化学。 各年级每班10名学生参加。 五、竞赛具体要求: 1、每月考试的前一周各班把参赛学生名单报到教务处。 2、要求参赛学生准时到场参加竞赛。 六、奖项设置: 共设三个奖项: 1、依据各年级学生单科成绩评出学生个人单项奖。即一等奖1名、二等奖2名、三等奖2名。 2、依据各年级学生全科成绩评出学生个人奖。即一等奖1名、二等奖2名、三等奖7名。 3、依据各班级学生总成绩,评出各年级班级优秀奖一名。 教务处 2017年9月
附: 注:1、每天的大课间+大课间后的一节课进行,大课间后的一节课串至第七节或自习课上。 2、监考:各年级主任 如遇学校重大活动,考试时间将适当调整。 要求:1、命题要严密,要符合学生的实际,排版要规范。 2、时长每场60分钟,满分100分。 3、每科考试的前1周将试题交到教务处。 三、考试进度安排: 1、各科考试前3周将考试当日的进度报到教务处。
高中化学竞赛用书推荐
高中化学竞赛用书推荐 常规/高考类: 化学岛 用户名: 密码:woaihuaxuedao 以下是另一个公邮 icholand. 密码:huaxuedaogongyou 提供公共邮箱的目的还是方便大家交流,如果遇到超出流量限制的问题,可以直接把邮件转发出去。 尽管以前有XX的Gbaopan。。但是貌似很多人并不清楚密码。。 附上: 部分优秀资料帖索引 《高中化学重难点手册》(华中师范大学出版社,王后雄老师主编);历年高考试题汇编(任何一种,最好有详细解析的,比如三年高考两年模拟);《高中化学读本》(很老的人民教育出版社甲种本化学教材,最近有更新版本);《高中化学研究性学习》(龙门书局,施华、盛焕华主编)南师大化科院创办的《化学教与学》每年的十套高考模拟题题型新颖质量比较高,可作为江苏预赛的模拟卷,不少5月份预赛原题就出自本套模拟题。 初赛类: 比较经典的有《化学高考到竞赛》(陕西师范大学出版社,李安主编,比较老);《高中化学奥林匹克初级本》(江苏教育出版社,段康宁主编);《高中化学竞赛初赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《高中化学竞赛热点专题》(湖南师范大学出版社,肖鹏飞、苏建祥、周泽宇主编,版本比较老,但编排体系不错);最新奥林匹克竞赛试题评析·高中化学》(南京师范大学出版社,马宏佳主编,以历年真题详细解析为主,可作为课外指导);《最新竞赛试题选编及解析高中化学卷》(首都师范大学出版社);《化学竞赛教程》(华东师范大学出版社,三本,王祖浩、邓立新、施华等人编写,适合同步复习),还有一套西南师范大学出版社的《奥林匹克竞赛同步教材·高中化学》(分高一、高二和综合卷,综合卷由严先生、吴先生、曹先生等参加编写,绝对经典),还有浙江大学出版社《高中化学培优教程》AB教程、《金牌教程·高一/二化学》(邓立新主编,南京大学出版社)。江苏省化学夏令营使用的讲义是马宏佳主编的《全国高中化学竞赛标准教程》(东南大学出版社),简明扼要,但由于不同教授编写不同章节,参差不齐;春雨出版的《冲刺金牌·高中化学奥赛辅导》(任学宝主编,吉林教育出版社)、《冲刺金牌·高中化学奥赛解题指导》(孙夕礼主编,吉林教育出版社)。《赛前集训·高中化学竞赛专题辅导》(施华编著,体现他的竞赛培训思维,华东师范大学出版社) 比较新颖的包括浙江大学出版社的林肃浩主编的竞赛系列《高中化学竞赛实战演练》(高一、高二)、《高中化学竞赛解题方法》、《冲刺高中化学竞赛(省级预赛)》、《冲刺高中化学竞赛(省级赛区)》、《高中化学竞赛解题方法》、《决战四月:浙江省高中化学竞赛教程(通向金牌之路)》《金版奥赛化学教程》(高一、高二、·综合)都是近年来体系、选题新颖的竞赛资料,足见浙江省对化学竞赛的重视,端木非常推荐。南京教研室刘江田老师2010年5月份主编的《高中化学竞赛全解题库》(南京大学出版社)选择了近年来省级赛区真题和各地新颖的预赛题,解析详细,适合缺少老师指导的同学参考。 决赛类: 比较经典的有《高中化学奥林匹克高级本》(江苏教育出版社,段康宁主编,完全按照大学的思路);《金牌之路高中化学竞赛辅导》以及配套解题指导书(陕西师范大学出版社,李安主编);《高中化学竞赛决赛辅导》(陕西师范大学出版社,李安、苏建祥主编);《历届国际化学奥林匹克竞赛试题分析》(学苑出版社);《最新国际国内化学奥林匹克竞赛优化解题题典》(吉林教育出版社),还有浙江大学出版社的浙江大学出版社《高中化学培优教程》“专题讲座”,《高中化学奥赛一
高中化学竞赛辅导参考资料(全)
绪论 1.化学:在分子、离子和原子层次上,研究物质的组成和结构以及物质的化学 性质和化学变化及其内在联系的科学。 应注意的问题: (1)化学变化的特点:原子核组成不变,发生分子组成或原子、离子等结合方式的改变; (2)认为物理变化不产生质变,不生成新物质是不准确的,如: 12H+3 1 H==42He+10n是质变,产生了新元素,但属于物理变化的范畴; (3)化学变化也有基本粒子参加,如:2AgCl==2Ag+Cl2就有光子参加; (4)物质 2.无机化学:除去碳氢化合物及其大多数衍生物外,对所有元素和他们的化合 物的性质和反应进行研究和理论解释的科学。(莫勒提法) 3.怎样学习无机化学? (1)你所积累的好的学习方法都适于学习无机化学。 (2)课前预习,带着问题听课。提倡写预习笔记。 (3)课上精力集中,边听边看边想边记,眼、耳、手、脑并用。 (4)课后趁热复习,按时完成作业,及时消化,不欠账。 (5)提高自学能力,讨论课积极发言。 (6)随时总结,使知识系统化。达到书越读越薄之目的。 (7)理论联系实际,做好化学实验。
第一章原子结构和原子周期系 教学目标:1.学会一个规则:斯莱特规则; 2.掌握两个效应:屏蔽效应、钻穿效应; 3.掌握三个原理:能量最低、保里不相容、洪特规则; 4.掌握四个量子数:n、l、l、m s 5.掌握五个分区:s、p、d、ds、f 6.掌握六对概念; 7.掌握七个周期; 8.掌握八个主族八个副族。 重点:1.原子核外电子排布三个原理,核外电子的四个量子数; 2.元素周期表的结构其及元素性质变化规律。 难点:屏蔽效应、钻穿效应概念及应用; 教学方法:讲授与讨论相结合,做适量练习题和作业题。 教学内容: §1-1经典物理学对原子结构的认识 1-1原子的核形结构 1708年卢瑟福通过α粒子散射实验确认:原子是由中央带正电的原子核和周围若干绕核旋转的电子组成。遇到的问题:电子绕核运动,将不断辐射电磁波,不断损失能量,最终将落到核上,原子因此而消亡实际与此相反,原子是稳定存在的,急需找到理论解释。 1-2 原子光谱的规律性 1光谱一束光通过分光棱镜折射后再屏幕上得到一条彩带或线形亮条前者称连续光谱后者称线形光谱太阳光电灯光为连续光谱原子光谱为线形光谱图1-1 2氢原子光谱里德堡方程 R H=1.097×10 M n1 郑州市高中学科竞赛 郑州市高中学科竞赛 简报 二○○九年第十三期 郑州市教育局教学研究室2009年12月17日2009年全国高中数学联赛成绩揭晓 2009年全国高中数学联赛河南省赛区成绩已揭晓。郑州市学生获一等奖27名,二等奖55名,三等奖84名。现将获奖名单公布如下: 一等奖(27人) 姓名学校姓名学校 林智慧河南省实验中学刘泽群郑州一中 姚博文河南省实验中学孙晓通河南省实验中学 薛菲河南省实验中学李佳航河南省实验中学 张高远河南省实验中学金婷伟郑州一中 徐晨轩河南省实验中学张帅郑州一中 李程河南省实验中学程宸郑州一中 张翮霄郑州一中段亦轩登封嵩阳高中 李金威河南省实验中学尹豪郑州外国语学校李致静河南省实验中学郝静雅郑州一中 苏晓磊新密中学史永竞河南省实验中学王益民河南省实验中学郭政扬河南省实验中学陈天珩郑州一中张睿智郑州一中 赵旭郑州一中郭倚辰郑州一中 常烨琳郑州二中 二等奖(55人) 姓名学校姓名学校 翟优河南省实验中学王美琪郑州一中 张逸伦郑州一中王喆河南省实验中学 李潇河南省实验中学王一琨郑州一中 周通郑州外国语学校喻泽良郑州一中 杨光郑州一中刘鹏新郑二中 黄维哲郑州一中刘雪娇郑州一中 雷博郑州一中李亚东新郑一中分校 刘思睿郑州一中刘德政河南省实验中学 尚承阳郑州一中柴奥郑州一中 李昊瀚河南省实验中学张鹏博郑州一中 刘志昕郑州一中郭月华郑州外国语学校 赵豪杰郑州外国语学校段松耀郑州四十七中 杜卓黎郑州外国语学校李盈郑州外国语学校 陈明辉郑州一中赵丹河南省实验中学 侯江燚郑州一中李海东郑州一中 刘文钊郑州一中王贺郑州外国语学校分校杨慧赟郑州一中丁瑞洲郑州一中 保德中学学科竞赛实施方案 为了进一步推进新课程的实施,贯彻新课程的相关思想理念,提高学生对学科的兴趣,丰富学生的学科学习活动,拓展学生的知识视野,培养学生的个性和特长,特制定保德中学学科竞赛实施方案。 指导思想: 本着丰富校本课程、提升学校和教研组学科教学水平的原则,以竞赛为载体,为学生搭建拓宽知识、激发兴趣、培养能力和展示自我的平台,提升学生的自信心和内在素质,为优秀学生的产生和发展创造条件,并为今后的高考打下扎实的基础。 具体实施方案: 一、学科竞赛类型 1、一类竞赛:由教育行政部门(市教研室)组织或参与,需要教师长期课外辅导,限时限场地进行竞赛,比赛结果能够使社会对学校的教学质量产生较大的正面评价。如:各级高中数学、语文、英语、物理、化学、生物、信息学(计算机)竞赛等。 2、二类竞赛:由教育行政部门(含教研室)组织或参与,限时限场地进行竞赛,竞赛结果能够使兄弟学校同学科教师对学校的教学质量产生一定的正面评价。如:英语学科演讲、综合能力等比赛,语文学科作文及征文竞赛,政史地知识竞赛,艺体类 竞赛、中学生辨论赛、小论文比赛,研究性学习成果评比,网页制作比赛等。 3、三类竞赛:本校组织的学科类竞赛,能够激励学生对学科的学习产生兴趣。 二、学科竞赛指导教师 根据学校要求,由教研组推荐,选定各学科竞赛辅导老师(兼班主任)同时由教研处牵头,教务、科技处配合成立学校学科竞赛领导组,原则上每学科由三名以上指导教师组成,指导教师具有5年以上教龄,业务素质和教学水平过硬。 三、参加辅导学生确定方法 对象主要是高一、高二学生,学生参加学科竞赛及辅导必须坚持自愿的原则,由各任课教师根据平时学习成绩,结合学校组织的月考、期中、期末考试成绩确定参赛人选,也可以通过校内学科竞赛进行选拔。一类竞赛参加辅导的人数一般为60人左右,以火箭班、示范班为主,普通班不超过5人(视具体情况而定)。一个学生一般参加一门学科的辅导,个别优秀的学生可以参加多门学科的辅导(但各备课组要相互协调好),具体名单由年级备课组长确定,并及时上报教科室,在以后的辅导过程可视实际情况进行参赛人员的调整。 四、学科竞赛辅导时间、地点安排 各学科在指定教室或实验室,利用下午活动时间或者晚三、晚四自习进行定时辅导,教研室专人检查登记。 全国高中学生化学竞赛大纲 说明: 全国高中学生化学竞赛分初赛(分赛区竞赛)和决赛(冬令营)两个阶段,加上冬令营后的国家队选手选拔赛共三个阶段。本基本要求旨在明确全国初赛和决赛试题的水平,作为试题命题的依据。国家队选手选拔赛需根据国际化学奥林匹克竞赛预备题确定,本基本要求不涉及。 现行中学化学教学要求以及考试说明规定的内容均属初赛内容。初赛基本要求在原理知识上大致与人民教育出版社《化学读本》的水平一致,但对某些化学原理的定量关系、物质结构、立体化学和有机化学上作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。初赛要求的描述化学知识以达到国际化学竞赛大纲一级水平为准,该大纲的二、三级知识均不要求在记忆基础上应用。 决赛基本要求是在初赛基本要求的基础上作适当补充,描述化学知识原则上以达到国际化学竞赛二级知识水平为度,该大纲的三级知识均不要求在记忆基础上应用。 本基本要求若有必要作出调整,在2001年8月中旬通告。 初赛基本要求 1.有效数字的概念。在化学计算和化学实验中正确使用有效数字。定量仪器(分析天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。运算结果的有效数字。 2.理想气体标准状态。理想气体状态方程。气体密度。气体相对分子质量测定。气体溶解度。 3.溶液浓度与固体溶解度及其计算。溶液配制(浓度的不同精确度要求对仪器的选择)。 重结晶估量。过滤与洗涤操作、洗涤液选择、洗涤方式选择。溶剂(包括混合溶剂)与溶质的相似相溶规律。 4.容量分析的基本概念——被测物、标准溶液、指示剂、滴定反应等。分析结果计算。 滴定曲线与突跃的基本概念(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)不要求滴定曲线定量计算。酸碱滴定指示剂选择的基本原则。高锰酸钾、重铬酸钾、硫代硫酸钠为标准溶液的滴定基本反应与分析结果计算。 5.原子结构——核外电子运动状态。用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),不要求对能级交错、排布规律作解释;不要求量子数;不要求带正负号的波函数角度分布图象。电离势、电子亲和势及(泡林)电负性的一般概念。6.元素周期律与元素周期系——主族与副族。主、副族同族元素从上到下的性质变化一般规律;同周期元素从左到右的性质变化一般规律;s、d、ds、p、f-区的概念; 元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数);最高化合价与族序数的关系;对角线规则;金属性、非金属性与周期表位置的关系。金属与非金属在周期表中的位置;半金属;主、副族重要而常见元素的名称、符号及在周期表中的位置、常见化合价及主要形态。 7.分子结构:路易斯结构式(电子式)。价层电子互斥模型对简单分子(包括离子)立体结构的预测。杂化轨道理论对简单分子(包括离子)立体结构的解释。共价键 p-p 全国高中化学竞赛资料 第一讲 原子结构。核外电子运动状态,用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),核外电子排布。电离能和电负性。 一、原子核 1.原子核 (1)原子的组成原子核和核外电子构成 (2)原子核的组成质子(p)和中子构成 (3)质量数(A)数值上等于质子数(Z)和中子(N)数之和,是质子和中子相对质量之和取其整数值。A=P+N (4)原子符号 (5)原子中的质量(由原子核的质量决定)、体积(由核外电子运动的空间区域决定)、电性(质子数等于核外电子数,电中性)关系 2.同位素 (1)元素具有相同核电荷数(质子数)的同一类原子(如1H、2H、3H)的总称 (2)核素具有确定的质子数和中子数的原子,氢元素有三种核素:1H、2H、3H (3)同位素同种元素不同种核素互称为同位素,如互称同位素 a.同位素的化学性质几乎相同 b.稳定核素在自然界中含量不变 c.重要同位素的应用(2H、235U、18O、14C等) 3.相对原子质量 (1)相对原子质量的定义 (2)核素(原子或同位素)的相对原子质量以1个12C质量的1/12作标准,其他核素的质量跟它的比值 (3)核素(原子或同位素)的近似原子量在数值上等于质量数 (4)元素的相对原子质量同种元素各种核素的相对原子质量的平均值(5)元素的近似原子量同种元素各种核素的近似相对原子质量的平均值例: 二、微观粒子的运动规律 (3)电子层(n)、电子亚层(l)、 n决定电子运动离核的距离 n和l决定电子的能量 a.s电子云球形一种状态 b.p电子云纺锤形三种取向(p x 、p y 、p z ) c.d电子云四叶花瓣形五种取向(d xy 、d yz 、d xz 、d x2-y2 、d z2 ) d.f电子云形状复杂 能级交错按ns、(n-2)f、(n-1)d、np顺序,能量由低到高3.核外电子排布规律 2020年初中数学、科学学科竞赛活动实施方案 2012 年初中数学、科学学科竞赛活动实施方案 一、指导思想 以“教师发展,学生成长,学校发展”的理念.在校领导的高度重视下,理科组开展以提升学生个人的综合素质和能力的数学竞赛活动.以提升学生的综合素质,增强创新意识,培养学生解决实际问题的能力,激发学生学习数学的兴趣有着极其重要的作用,同时也能推动教 学改革与教育创新的进程. 二、活动目的 通过活动,拓宽学生的知识面,开发智力,挖掘潜能,发展个性和特长,让一些资质聪慧学有余力的学生得到更好的锻炼和培养.同时营 造良好的校园学生学习氛围,鼓励学生积极参与、大胆创新、增强竞争意识,提高知识应用能力,体验知识所带来的乐趣. 二、活动安排 负责人:理科组全体教师 时间:2012年12月27-28日11:50----13:20 考试地点:多媒体教室 参赛对象:七年级,八年级,九年级---每班选拔10人参加数学,科学试题竞赛. 参加选手名单请各班教数学,科学的教师在2012年12月21日下班之前上交. 命题教师:七数--张亚洲八数--孙泉九数--姜义林 七科―闫守龙八科--李俊九科--任乐平 监考教师:七、八、九数学---张亚洲.孙泉 七、八、九科学---任乐平,闫守龙 各监考教师收卷后按考号顺序由小到大统一装订、密封批卷,认真统计好各年级学生的竞赛分数,统计表于监考结束后两天内上报. 监考不在敲钟,监考教师自己掌握时间. 三、命题原则 1、命题力求多样新颖,兼具知识性和趣味性,体现本学科知识的综合应用,能提高学生的思考和分析问题、解决问题的能力. 2、根据我校实际情况,以年级为单位,以课本上的基础知识作为基本,适当拓展,力求难易适中. 四、奖项设置 按年级根据分数的高低各设一等奖1名,二等奖2名,三等奖3名,获奖者颁发奖品和奖状. 五、注意事项 1、参赛学生应准时到位,凡在规定时间内未出现者视为主动弃权. 2、组织人员要做好学生安全防范工作,确保活动有序、顺利进行. 3、活动结束,应组织学生清扫考场,关好门窗. 萧西实验学校教务处 初中理科教研组 2012年12月18日 中国化学会第 21届( 2019 年)全国高中学生化学竞 赛 (省级赛区)试题 时间: 3 小时 满分: 100 分) 1 2 3 4 5 6 7 8 9 10 11 总分 满分 12 6 10 7 10 12 8 4 10 12 9 100 H 1.008 相对原子质量 He 4.003 Li Be B C N O F Ne 6.941 9.012 10.81 12.01 14.01 16.00 19.00 20.18 Na Mg Al Si P S Cl Ar 22.99 24.31 26.98 28.09 30.97 32.07 35.45 39.95 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 39.10 40.08 44.96 47.88 50.94 52.00 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.80 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 85.47 87.62 88.91 91.22 92.91 95.94 [98] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 Cs Ba La - Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 132.9 137.3 Lu 178.5 180.9 183.8 186.2 190.2 192.2 195.1 197.0 200.6 204.4 207.2 209.0 [210] [210] [222] Fr [223] Ra [226] Ac - Lr Rf Db Sg Bh Hs Mt Ds Rg 第一题(12 分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成 Si (OH ) 4 1.已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪 50 年代就发现了 CH 5+ 的存在,人们曾提出该离子结构的种种假设,然而,直 至 1999 年才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢 原子围绕着碳原子快速转动;所有 C - H 键的键长相等。 2.该离子的结构能否用经典的共价键理论说明?简述理由。 第二题( 6分) 羟胺和用同位素标记氮原子( N* )的亚硝酸在不同介质中发生反应,方程式如下: NH 2OH + HN*O 2→A +H 2O NH 2OH +HN*O 2→B +H 2O A 、 B 脱水都能形成 N 2O ,由 A 得到 N*NO 和 NN*O ,而由 B 只得到 NN*O 请分别写出 A 和 B 的路易斯结构式。 ) 路易斯酸 3.该离子是( A 质子酸 B 2003年 5月报道, 在石油中发现一种新的烷烃分子, 子钻石”,若能合成,有可能用作合成纳米材料的理想模板。该分子的结构简图如下: 4.该分子的分子式为 C 自由基 D 亲核试剂 因其结构类似于金刚石, 被称为 “分 6.该分子有几种不同级的碳原子? 7.该分子有无手性碳原 子? 高一数学竞赛试题 一、单选题(8×5′=40′) 1、已知集合{}27A x x =-≤≤,{}121B x m x m =+<<-且B ≠?,若A B A =,则( ) (A)34m -≤≤ (B)34m -<< (C)24m << (D)24m <≤ 2、已知()1,2a =,(),2b x =-且()a a b ⊥-,则实数x 为( ) (A)-7 (B)9 (C)4 (D)-4 3、同时掷两枚骰子,得到的点数和为6的概率是( ) (A)5 12 (B)5 36 (C)19 (D)5 18 40y m -+=与圆22220x y x +--=相切,则实数m 等于( ) (C)--5、函数2sin 24y x π?? =- ???的一个单调递减区间是( ) (A)3 7 ,88ππ?????? (B)3,88ππ?? -???? (C)3 5 ,44ππ?????? (D),44ππ?? -???? 6、一个与球心距离为1的平面截球所得圆面面积为π,则球的表面积为( ) (A) (B)8π (C) (D)4π 7、直线210x y -+=关于直线1x =对称的直线方程是( ) (A)210x y +-= (B)210x y +-= (C)230x y +-= (D)230x y +-= 8、已知定义在R 上的奇函数()f x 满足()()2f x f x +=-,则()6f 的值为( ) (A)-1 (B)0 (C)1 (D)2 二、填空题(6×5′=30′) 9、方程()21033log 1log x x -=+的解是 。 10、正方体的内切球与其外接球的体积之比为 。 11、过点()1,3-且平行于直线230x y -+=的直线方程为 。 12、方程sin 10 x x = 有 个根。 13、已知()1sin 2πα+=-,则cos α= 。 14、已知()1,2a =,()2,3b =-,则a 在b 上的射影长 。 三、解答题(第15、16题各12分,第17、18、19、20题各14分) 15、若对于一切实数x 、y ,都有()()()f x y f x f y +=+ (1)求()0f 并证明()f x 为奇函数; (2)若()13f =,求()3f -。 16、为了了解某市工厂开展群众体育活动的情况,拟采用分层抽样的方法从A 、B 、 C 三个区中抽取7个工厂进行调查,已知A 、B 、C 区中分别有18、27、18个工厂。 (1)求从A 、B 、C 区中应分别抽取的工厂个数; (2)若从抽得的7个工厂中随机抽取2个进行调查结果的对比,用列举法计算这 2个工厂中至少有1个来自A 区的概率。 江陵中学学科竞赛 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】 江陵中学学科竞赛(奥赛)辅导管理方案 为提高我校的综合竞争力,使竞赛辅导成为我校教学成果一大亮点,现对竞赛辅导的有关工作进一步明确如下: (一)辅导班的成立及教学安排 1、数学、物理、化学、生物学科从高二年级开始,分别成立一个辅导班,各班人数为35~40人。 2、辅导班的学员通过学校组织初赛决定。 3、各学科成立竞赛辅导小组,组长由教练员之一担任,辅导教师3人。 4、竞赛辅导时间为每周三课外活动、周六下午三节课,共四节课。辅导内容由组长在学期初确定课题及相关辅导教师。课表由教务处统一安排,并由教务处专人检查。 5、辅导教师必须认真备课,不得无教案上课。备课情况由教务处按教学常规检查的要求进行检查,并按备课时数与上课时数相结合核发津贴。 6、每学期各辅导学科要至少进行3~4次强化训练检测,并把成绩及试卷交教务处存档,建立学生台帐制度。 (二)辅导教师的津贴及奖金发放办法 1、辅导教师的津贴与竞赛成绩相结合。平时按30元/节发放, 竞赛获得 荆州区、荆州市团体总分第一名,分别每节课另补发津贴5元、10元。 2、学生获奖后,按竞赛成绩给予相关教师奖励,标准如下:国家级一等奖800元/人、二等奖600元/人、三等奖500元/人;省级一等奖500元/人、二等奖300元/人、三等奖100元/人;市级一等奖100元/人。 若一名学生获多次奖,按最高奖发放辅导教师奖金。 若学生进入国家冬令营集训队,奖给教师2万元。 3、学校发给教师的奖金,70%给辅导教师,30%给科任教师。 教务处 2008年9月11日 龙文中学学科竞赛计划实施方案 为进一步提升我校办学档次,加大学科教学的管理力度,规范学科竞赛工作,提高学科竞赛(奥赛)训练质量,形成有力的奥赛激励长效机制,开创我校奥赛工作新局面,在面向全体学生、全面发展的基础上,突出学生个性发展,以奥赛促教学,全面提高教育教学质量,根据上级要求和本校实际,特制定本方案。 一、目标任务 1、把学科竞赛(奥赛)工作列入学校常规工作内容,落实、分解到各教研组、备课组,使学科竞赛健康持久地开展下去,突出延续性,并日趋规范化。 2、通过学科竞赛促进教师专业成长,逐渐培养一批名牌教师和学科骨干教师,从而带出一支高素质的教师队伍。 3、拓展学科竞赛范围,以校级学科竞赛为基点,要求各学科组以年级为单位进行学科竞赛,一方面推动学科教研组建设,突出学生个性, 高中化学竞赛知识点 有机是大头,命名结构性质都可以出题,还可以和配合物晶体结合,《有机化学》(北大出的)要求的都要掌握,再做做关于合成、性质的题,推荐丁漪出的《化学竞赛教程》(最好用解答的那本),好好研究一下。 结构式重点和难点。有多做一些分子结构配合物结构的题,基本的知识掌握了,这两块应该没太大问题。晶体很难,即使做很多题也不一定可以掌握,但基本的份不可以丢。原子结构已经很多年没有考了,如果再考肯定考分析信息的能力,应该不会很难。滴定每年会有一道大题。而且越来越重视,如果运气好只是一道高中就会的计算,但运气不好的化就会遇到《分析化学》里的内容。化学平衡考的比较简单,但要有备无患。电化学可能会出难题,多看一下《无机化学》,会有启发。有效数字不可以不注意,大学和高中的要求不同,改卷老师都遵循大学的标准,只有规范才能不丢无谓的分。物理化学和溶液已经多年未考,但热力学的内容是决赛里的难点,看自己有没有必要学这个了。作为一个过来人,还有几个建议:如果你是分析型的。就多做一些题,做题可以让水平提高很多,如果是记忆型的,就多看看书,尤其是有机无机,虽然每年都出一些新信息,但它的模型在书上都能找到。最后祝你取得好成绩。 附化学竞赛大纲(一般不会改动) 说明: 1. 本基本要求旨在明确全国高中学生化学竞赛初赛及决赛试题的知识水平,作为试题命题的依据。本基本要求不包括国家代表队选手选拔赛的要求。 2. 现行中学化学教学大纲、普通高中化学课程标准及高考说明规定的内容均属初赛要求。高中数学、物理、生物、地理与环境科学等学科的基本内容(包括与化学相关的我国基本国情、宇宙、地球的基本知识等)也是本化学竞赛的内容。初赛基本要求对某些化学原理的定量关系、物质结构、立体化学和有机化学作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。 3. 决赛基本要求在初赛基本要求的基础上作适当补充和提高。 4. 全国高中学生化学竞赛是学生在教师指导下的研究性学习,是一种课外活动。针对竞赛的课外活动的总时数是制定竞赛基本要求的重要制约因素。本基本要求估计初赛基本要求需40单元(每单元3小时)的课外活动(注:40单元是按高一、高二两年约40周,每周一单元计算的);决赛基本要求需追加30单元课外活动(其中实验至少10单元)(注:30单元是按10、11和12月共三个月约14周,每周2~3个单元计算的)。 5. 最近三年同一级别竞赛试题所涉及的符合本基本要求的知识自动成为下届竞赛的要求。 6. 本基本要求若有必要做出调整,在竞赛前4个月发出通知。新基本要求启用后,原基本要求自动失效。 初赛基本要求 1. 有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2. 气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3. 溶液溶液浓度。溶解度。浓度和溶解度的单位与换算。溶液配制(仪器的选择)。重结晶方法以及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶 1-3该离子是()。 A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4该分子的分子式为; 1-5该分子有无对称中心? 1-6该分子有几种不同级的碳原子? 1-7该分子有无手性碳原子? 1-8该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→A+H2O NH2OH+HN﹡O2→B+H2O A、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。 第3题(8分) X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。 3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层 型结构的堆积方式。 3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第4题(7分) 化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表: 利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。 第5题(10分) 甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g 样品,与25mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。郑州市高中学科竞赛
保德中学学科竞赛实施方案实施计划书设计
全国高中学生化学竞赛初赛大纲
全国高中化学竞赛资料
2020年初中数学、科学学科竞赛活动实施方案
中国化学会第21届(2019年)全国高中学生化学竞赛(省级赛区)试题和答案(内部资料,请不要上传到互
高一学科竞赛(数学)模拟附答案
江陵中学学科竞赛
高中化学竞赛知识点
全国高中学生化学竞赛初赛试题及答案
相关文档
- 中学数学(高中)学科竞赛集锦 (9)
- 全国高中数学联赛--平面几何(赛题精选1)及解答
- 高一学科竞赛(培优)课程计划
- 全国市级及以上各学科竞赛项目一览(除五大竞赛外)
- 高中百科知识竞赛试题+答案
- 对高中学科竞赛的建议
- 中学数学(高中)学科竞赛集锦 (24)
- 郑州市高中学科竞赛
- 郑 州 市 高 中 学 科 竞 赛
- 高中物理竞赛讲义-运动学专题
- 高一生物必修二学科竞赛题目
- 郑州市高中学科竞赛
- 2015年高中数学竞赛试题及答案及答案
- 高校自主招生对五大学科竞赛奖项要求
- 高中学科竞赛保送加分政策解读
- 2018高中,各项竞赛
- 高中阶段各类竞赛简介
- 中学数学(高中)学科竞赛集锦 (19)
- 高一学科知识竞赛方案
- 中学数学(高中)学科竞赛集锦 (20)
